本田招聘研究員室
研究紹介
本田招聘研究員室は、タンパク質工学、合成生物学の研究を行っています。生物物理化学、タンパク質科学、構造生物学、進化分子工学、計算化学等の横断的理解を基盤として、メディカル分野での活用を目的とした機能性人工タンパク質の創製やバイオ医薬品産業に資する基盤技術の開発を進めています。
1.世界最小タンパク質の分子設計と結晶構造
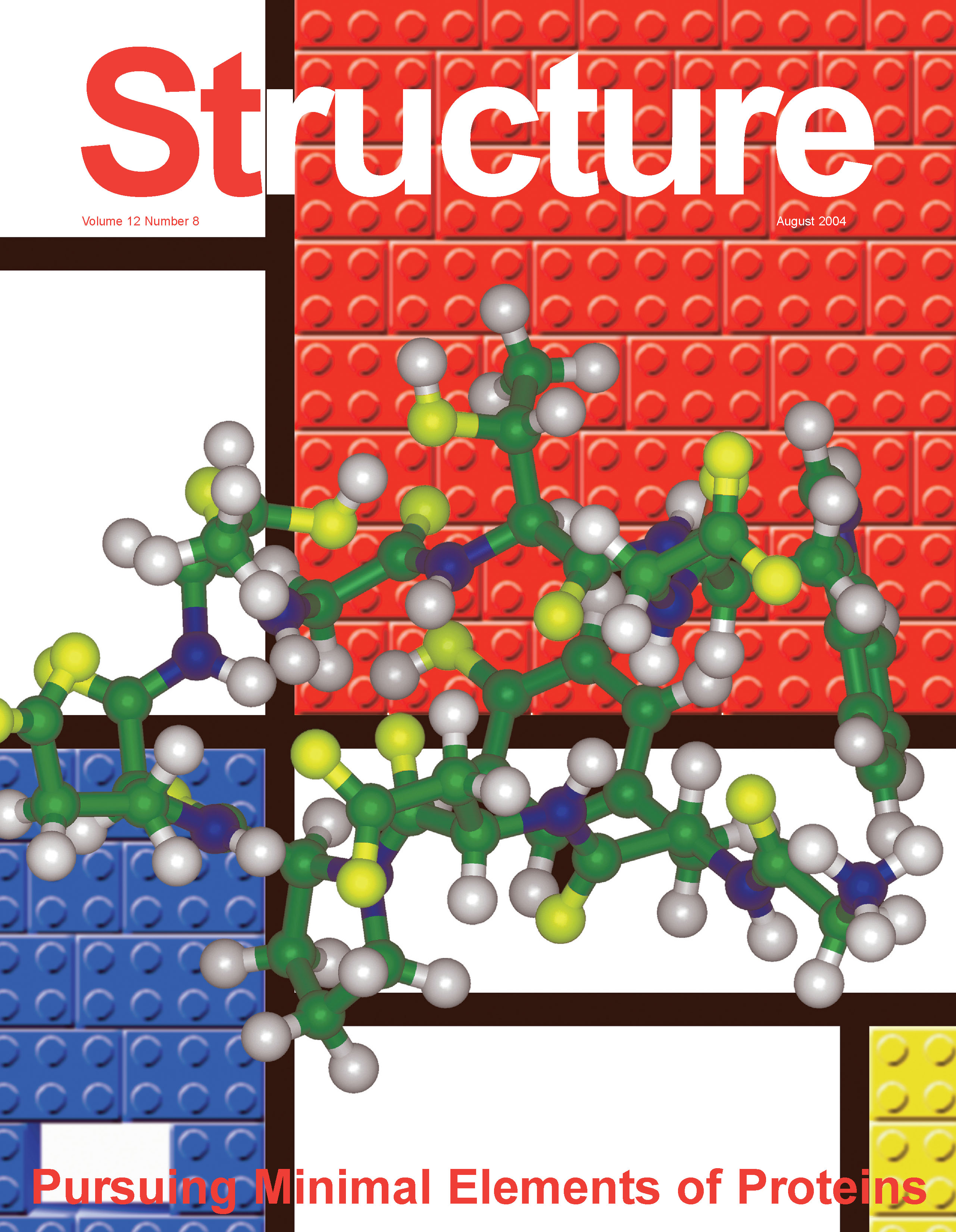 タンパク質の化学進化とフォールディング機構の類比に基づく独自の仮説「自律要素説」を提案し、仮説に立脚した分子設計プログラムを開発し、これを用いて従来の常識を超えるわずか10アミノ酸からなる微小な人工タンパク質の創出に成功しました。これまではタンパク質が安定な立体構造を形成するには、最低でも30~50個のアミノ酸が必要であるとの見方が支配的でした。しかし、シニョリンと命名したこの極微小タンパク質は、この下限を大きく下回るにもかかわらず、水溶液中で安定な立体構造を形成し、昇降温に伴い可逆的かつ協同的に変性/再生します。この事実の発見は、タンパク質の構造単位に関する従来の認識に修正を促すものとなり、海外の科学専門誌の表紙を飾る論文となりました。また、シニョリンの存在は、生命起源の研究にも大きな影響を及ぼすことから、新聞等でも広く取り上げられました。その後、シニョリンの配列を最適化したさらに安定なスーパーシニョリンを開発し、その結晶構造の決定にも成功しました。この成果は、結晶化しうる「最小のタンパク質」であることから、フォールディング機構から新薬分子設計まで広範な研究展開への波及が期待され、アメリカ化学会が発行する一般向け科学誌のホットトピックスとして取り上げられるなど、世界的に高い評価を受けています。
タンパク質の化学進化とフォールディング機構の類比に基づく独自の仮説「自律要素説」を提案し、仮説に立脚した分子設計プログラムを開発し、これを用いて従来の常識を超えるわずか10アミノ酸からなる微小な人工タンパク質の創出に成功しました。これまではタンパク質が安定な立体構造を形成するには、最低でも30~50個のアミノ酸が必要であるとの見方が支配的でした。しかし、シニョリンと命名したこの極微小タンパク質は、この下限を大きく下回るにもかかわらず、水溶液中で安定な立体構造を形成し、昇降温に伴い可逆的かつ協同的に変性/再生します。この事実の発見は、タンパク質の構造単位に関する従来の認識に修正を促すものとなり、海外の科学専門誌の表紙を飾る論文となりました。また、シニョリンの存在は、生命起源の研究にも大きな影響を及ぼすことから、新聞等でも広く取り上げられました。その後、シニョリンの配列を最適化したさらに安定なスーパーシニョリンを開発し、その結晶構造の決定にも成功しました。この成果は、結晶化しうる「最小のタンパク質」であることから、フォールディング機構から新薬分子設計まで広範な研究展開への波及が期待され、アメリカ化学会が発行する一般向け科学誌のホットトピックスとして取り上げられるなど、世界的に高い評価を受けています。
2.主鎖環状型サイトカインのデザイン
 バイオ医薬品として認可済みのサイトカインタンパク質の両末端をアミド結合で連結した主鎖環状化サイトカインをデザインし、合成した改変体の機能と構造に関する分子特性を評価しました。対象としたサイトカインは顆粒球コロニー刺激因子(G-CSF)で、ヒト組換えG-CSFはがん化学療法に伴う好中球減少症等の治療薬として広く臨床に利用されています。独自の連結配列設計プログラムを用いて最適な連結鎖長をコンピュータでデザインし、スプリットインテイン発現ベクターを活用してプロテインスプライシング法により合成した主鎖環状型G-CSFを、円偏光二色性法、表面プラズモン共鳴法、蛍光スペクトル法、培養細胞バイオアッセイ、X線結晶解析法、分子動力学シミュレーション法、小角X線散乱法、分析超遠心法等により解析したところ、主鎖環状型G-CSFの高次構造、レセプター結合活性および細胞増殖活性は野生型と同等であり、かつその構造安定性とプロテアーゼ分解耐性は野生型より優れたものであることが明らかになりました。また、構造安定性向上の理由は、環状化による変性状態の鎖エントロピー減少と水素結合の増加による天然状態のエンタルピー増加の相乗効果であることも明らかになりました。この成果は、この改変サイトカインが保存安定性を向上させたバイオベター型後続バイオ医薬品として有望な創薬シーズであることを示すものであると共に、コンピュータデザインによる主鎖環状化が優れた合理的タンパク質工学戦略であること示しています。
バイオ医薬品として認可済みのサイトカインタンパク質の両末端をアミド結合で連結した主鎖環状化サイトカインをデザインし、合成した改変体の機能と構造に関する分子特性を評価しました。対象としたサイトカインは顆粒球コロニー刺激因子(G-CSF)で、ヒト組換えG-CSFはがん化学療法に伴う好中球減少症等の治療薬として広く臨床に利用されています。独自の連結配列設計プログラムを用いて最適な連結鎖長をコンピュータでデザインし、スプリットインテイン発現ベクターを活用してプロテインスプライシング法により合成した主鎖環状型G-CSFを、円偏光二色性法、表面プラズモン共鳴法、蛍光スペクトル法、培養細胞バイオアッセイ、X線結晶解析法、分子動力学シミュレーション法、小角X線散乱法、分析超遠心法等により解析したところ、主鎖環状型G-CSFの高次構造、レセプター結合活性および細胞増殖活性は野生型と同等であり、かつその構造安定性とプロテアーゼ分解耐性は野生型より優れたものであることが明らかになりました。また、構造安定性向上の理由は、環状化による変性状態の鎖エントロピー減少と水素結合の増加による天然状態のエンタルピー増加の相乗効果であることも明らかになりました。この成果は、この改変サイトカインが保存安定性を向上させたバイオベター型後続バイオ医薬品として有望な創薬シーズであることを示すものであると共に、コンピュータデザインによる主鎖環状化が優れた合理的タンパク質工学戦略であること示しています。
3.抗体医薬品の凝集化メカニズム
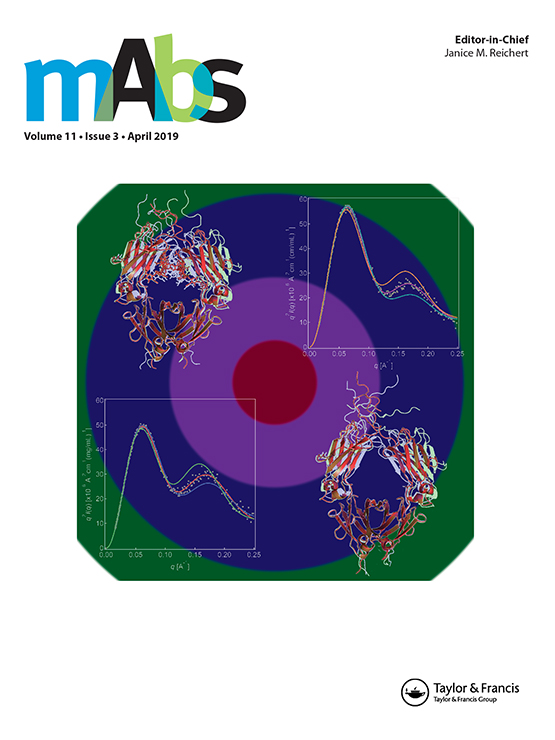 多くのバイオ医薬品の有効成分はタンパク質ですが、タンパク質は低分子化合物に比べ不安定で、物理的にも化学的にも劣化しやすいです。なかでも変性に伴う凝集は、薬効の低下のみならず免疫原性を示す可能性があることから、バイオ医薬品の品質管理上の懸念事項となっています。そこで、私たちは、安全安心のためのさらなる高品質生産に貢献することを目指し、ヒトモノクローナル抗体の凝集化メカニズムの解明、実用に資する理論モデルの構築に取り組んでいます。しかし、バイオ医薬品の凝集は、長期の緩和過程を伴う非平衡系、濃度依存を示す非理想系、添加剤の影響を受ける多成分系での反応であり、理論化学の対象として手強い相手です。対象がタンパク質であるため、さらに配列依存性や構造変化の影響も含まれます。平衡論的に微量な、あるいは速度論的に短寿命な変性状態の分子が重要な役割を果たします。これらを統一的に理解することは容易でないことを覚悟のうえ、少しでも前進させようと奮闘しています。私たちは、特に抗体を酸性溶液に一定時間さらしたのち中和して再び中性に戻すと凝集が発生する現象(pHシフトストレス負荷)に注目しています。この現象を動的光散乱法、小角X線散乱法、分析超遠心法、走査電子誘電率顕微鏡法、蛍光相関分光法等の分析法で多角的に解析して、抗体の凝集体はアミロイド線維のような自己触媒的な増殖性を持たないこと、コロイド化学の古典であるスモルコフスキー凝集式モデルに従って凝集成長すること、発生する凝集体の形状はフラクタルであり自己相似性(スケールフリー性)が満たされること、N型糖鎖の除去でCH2ドメインのopen構造は誘起されないことなどを報告しています。
多くのバイオ医薬品の有効成分はタンパク質ですが、タンパク質は低分子化合物に比べ不安定で、物理的にも化学的にも劣化しやすいです。なかでも変性に伴う凝集は、薬効の低下のみならず免疫原性を示す可能性があることから、バイオ医薬品の品質管理上の懸念事項となっています。そこで、私たちは、安全安心のためのさらなる高品質生産に貢献することを目指し、ヒトモノクローナル抗体の凝集化メカニズムの解明、実用に資する理論モデルの構築に取り組んでいます。しかし、バイオ医薬品の凝集は、長期の緩和過程を伴う非平衡系、濃度依存を示す非理想系、添加剤の影響を受ける多成分系での反応であり、理論化学の対象として手強い相手です。対象がタンパク質であるため、さらに配列依存性や構造変化の影響も含まれます。平衡論的に微量な、あるいは速度論的に短寿命な変性状態の分子が重要な役割を果たします。これらを統一的に理解することは容易でないことを覚悟のうえ、少しでも前進させようと奮闘しています。私たちは、特に抗体を酸性溶液に一定時間さらしたのち中和して再び中性に戻すと凝集が発生する現象(pHシフトストレス負荷)に注目しています。この現象を動的光散乱法、小角X線散乱法、分析超遠心法、走査電子誘電率顕微鏡法、蛍光相関分光法等の分析法で多角的に解析して、抗体の凝集体はアミロイド線維のような自己触媒的な増殖性を持たないこと、コロイド化学の古典であるスモルコフスキー凝集式モデルに従って凝集成長すること、発生する凝集体の形状はフラクタルであり自己相似性(スケールフリー性)が満たされること、N型糖鎖の除去でCH2ドメインのopen構造は誘起されないことなどを報告しています。
業績リスト
|2024年|2023年|2022年|2021年|2020年|2019年以前|
![本田真也招聘研究員技術シーズ紹介[PDF:1.6MB]](img/honda_pic2023.jpg)