バイオ構造活性相関研究グループ(つくばセンター)
◇研究紹介◇
バイオ構造活性相関(BioSAR)とは
「構造活性相関」とは、医薬品候補分子の構造と活性の関係性を導き出し、優れた特性の薬を創出するアプローチのことです。SAR(Structure-Activity Relationship)とも呼ばれます。分子の「かたち(構造)」と「はたらき(活性)」の間には何らかの「つながり(相関)」があり、それを解き明かすことが、最適な分子創出への鍵であるという考え方に基づいています。私たちバイオ構造活性相関研究グループは、生体分子の構造を解析し制御することでバイオの力を最大限に引き出し、創薬に限らず高機能性バイオ分子の創出を目指しています。生物物理学、生化学、分子生物学の接続点に位置し、専門性の異なる研究者集団が結集することで、学際的な課題の解決を加速するゲートウェイを形成しています。以下の3つの基盤技術開発を通じて、革新的な分子を創出するための技術プラットフォーム構築を進めています。
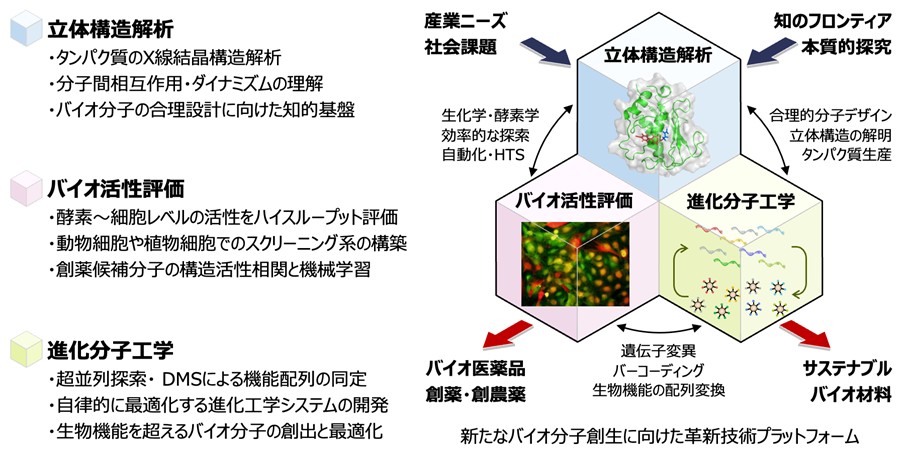
1. 立体構造解析
立体構造解析は、バイオ分子の合理的設計に不可欠な技術です。特に、タンパク質-リガンドの相互作用の理解は創薬において重要で、X線結晶構造解析を用いることで、分子の三次元構造を高精度で決定できます。遺伝子構築からタンパク質精製、結晶化スクリーニングまでをシステマティックにワークフロー化しています。近年、解析効率を向上させるためにロボティクス自動化や機械学習が導入され、データ収集や構造解析が迅速に行えるようになりました。この技術により、分子間相互作用や分子認識ダイナミズムを高精度に理解し、薬剤の設計を効率的に進めています。もちろんAlpha-Foldの様なシミュレーションも活用していますが、X線結晶構造解析は実測データであり、確固たる知的基盤となります。これらの立体構造情報とバイオ活性情報を統合することで、リガンド分子の構造展開や遺伝子変異への対応できる新規分子創出に取り組んでいます。
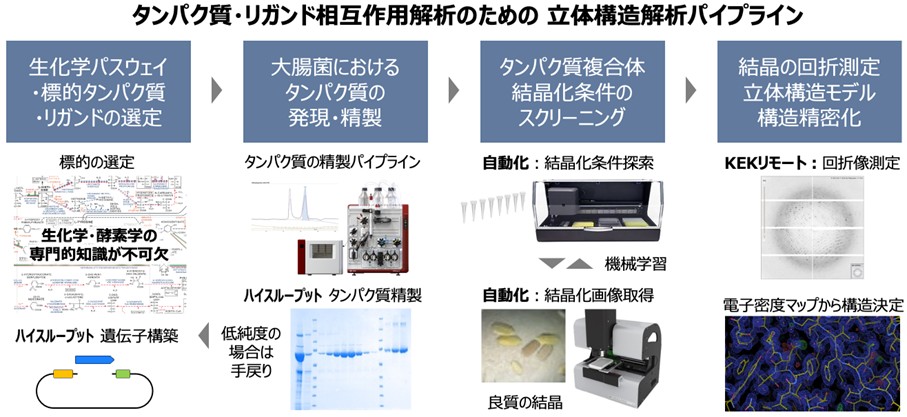
【研究事例 1.1】 除草剤開発に向けた構造解析と合理設計 特にシミュレーションが難しいのは、タンパク質と低分子化合物との複合体についての評価です。タンパク質と強力に結合する化合物ほど、タンパク質の形状に大きな変化を引き起こし、それが薬剤の活性の原動力にもなりますが、このような構造変化を推測することは容易ではありません。除草剤開発では、植物が生育するために必要な生化学パスウェイを標的とした上で、鍵となるタンパク質因子に狙いを定め、化合物をデザインしていきます。結晶構造解析を行なった例では、酵素の触媒ポケットにピッタリとはまり込み、タンパク質の構造を大きく変化させていることを明らかにしました。このような相互作用原理を明らかにすることで、新たな薬剤候補の設計に取り組んでいます。
2. バイオ活性評価
立体構造情報にもとづいて、リガンド候補分子や遺伝子変異を設計することは重要ですが、それらが生体内で思い通りに機能するとは限りません。膨大な候補分子ライブラリー(〜10,000種類)の中から、有望な創薬候補分子を探索するためには、ハイスループットスクリーニング(HTS)実験系を組み立てる必要があります。HTS実験系には、クラシックな生化学を駆使した酵素評価系と、細胞からの応答を測定するセルベース評価系があります。セルベース評価系を効果的に構築する手法として、ゲノム編集を用いて、特定の遺伝子をターゲットにしたモデル細胞を作成することで、細胞内での正確な応答を評価しています。レポーター遺伝子(蛍光タンパク質やルシフェラーゼ等)を使って、miRNAの細胞内発現を可視化させることにも成功しています。また、微生物、動物培養細胞、植物培養細胞といった多様なモデル生物システムを取り扱っており、幅広いニーズに応じたクロスプラットフォームの評価技術開発に取り組んでいます。

【研究事例 2.1】 感染症治療薬開発に向けたハイスループットスクリーニング系開発 立体構造情報に基づきバイオ分子の活性制御を行う例として、感染症の治療薬などにも使われる酵素阻害剤があります。この酵素阻害剤の開発には、薬剤の標的となる酵素を特定する「標的探索」技術と、酵素阻害剤の元となるリガンド候補分子を見つけ出す「化合物スクリーニング」技術が不可欠です。標的探索では、病原性微生物やウイルスの特定の遺伝子のはたらきをゲノム編集により止めることで、その遺伝子が産み出す酵素が創薬標的になり得るかどうかを評価することが可能です。「化合物スクリーニング」では膨大な化合物ライブラリの中から標的の活性を阻害するリガンド分子を選別しますが、このとき、精製された酵素の活性評価だけではなく、培養細胞内でのリガンド分子の影響を評価することも重要です。当グループでは、レポーター遺伝子や画像解析を用いることで、従来に比べてハイスループットに細胞ベースの評価を行うことを可能にするプラットフォームの構築に取り組んでいます。
【研究事例 2.2】 植物培養細胞を活用したバイオものづくり 当グループの強みの一つとして、植物培養細胞を自在に扱うことができる点があります。植物の生命現象を理解する上では個体での解析が欠かせませんが、分子レベルでの解析にフォーカスを当てるのであれば、スループット性や均一性に優れる培養細胞に軍配があがります。遺伝子やタンパク質を導入するための手法論を開発し、膨大なノウハウを蓄積してきました。その結果として、多様な遺伝子配列を並列的にスクリーニングする手法や、ゲノム編集を評価する手法として論文化してきました。これらの技術を集約することにより、「植物培養細胞を用いた高品質タンパク質の生産」が可能であると考えています。実験室で用いられている植物培養細胞株は、2日〜5日の倍化時間、無機塩(窒素・リン・カリウム等)とスクロースを含む培地、25度付近の温和な培養条件、高い容積率を実現する高密度培養という「培養の低コスト・低環境負荷」に加えて、ヒトや動物等への病原体の混入リスク低、遺伝子を導入しても非GMOであるという「安全性」も兼ね備えています。さらに、細胞外への分泌生産により精製を容易にすることも可能です。これらの特性はバイオ医薬品、経口ワクチン、高機能ペプチド素材など、幅広い用途に展開することが期待されます。
3. 進化分子工学
バイオ医薬品として活用できる遺伝子配列を、さらに最適化するため、進化分子工学を活用しています。目的通りの機能を発揮する遺伝子配列を取得するためには、表現型(Phenotype)を遺伝子型(Genotype)へと変換する必要があり、進化分子工学によって最適なバイオ分子を探索することが可能です。多種類の配列を生み出す「変異」と、機能性の向上した分子を「選別」し、その遺伝子を「増幅」させるサイクルを繰り返すプロセスを試験管内で行います。これまでに新規DNAアプタマーや機能性RNA(リボザイム等)を創出してきました。また、目的遺伝子にのみ自動的に変異を導入し、高活性な分子を発現する細胞のみを選別して培養を続けるだけで、遺伝子配列が最適化される「加速進化システム」を構築しています。超並列探索(CRISPRスクリーニング等)も活用しながら、生物を模倣し生物機能を超える「バイオものづくり」を行なっています。
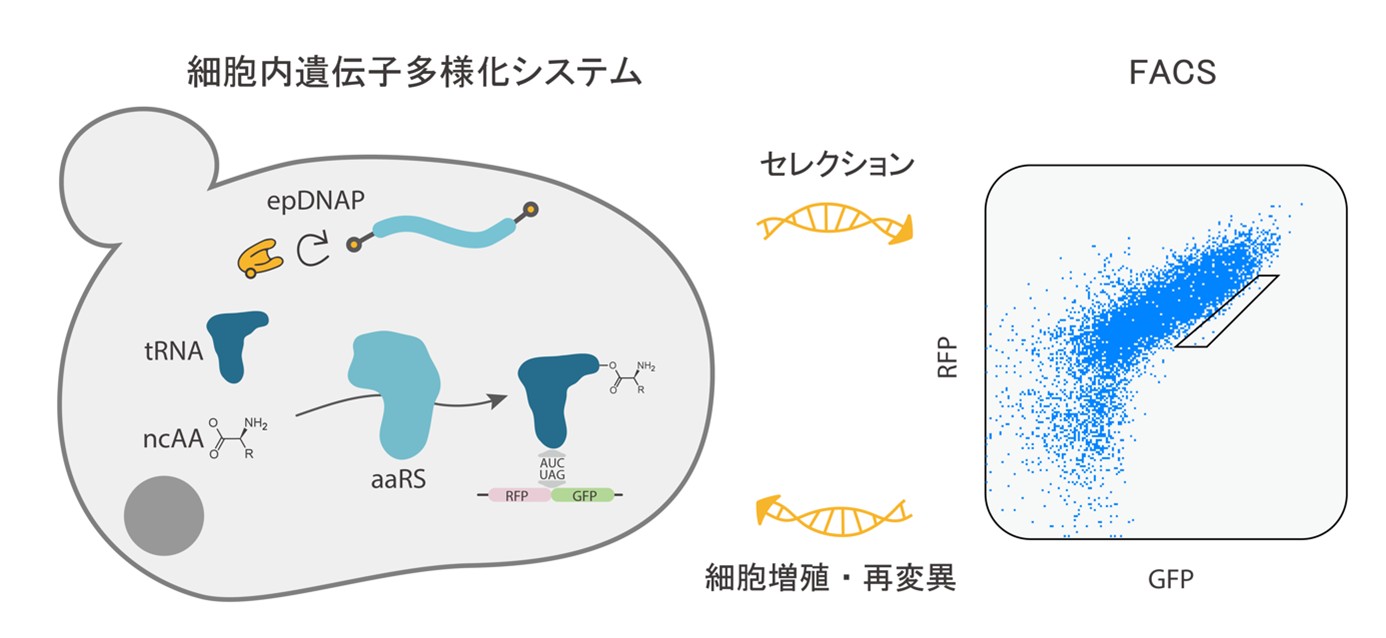
【研究事例 3.1】 非天然アミノ酸の導入による人工タンパク質の創製と加速進化 私たちは、細胞内で狙った遺伝子を進化させるin vivo進化システムを活用し、有用な酵素の高速改変や、人工翻訳システムの構築を目指しています。in vivo進化システムとは、細胞増殖に伴って特定の遺伝子のみに変異が蓄積され、その遺伝子が発現するタンパク質の機能に応じて細胞を選別することで、目的に適合した進化型遺伝子を効率的に取得できる技術です。現在は、遺伝暗号の拡張に不可欠な酵素であるアミノアシルtRNA合成酵素の進化に注力していますが、今後はペプチド合成酵素やプロテアーゼ、T7 RNAポリメラーゼなど、産業や研究に役立つ酵素の特異性や活性の改良にも取り組んでいきます。さらに、アミノアシルtRNA合成酵素の進化を応用し、自然界では20種類に限られているアミノ酸の利用を、人工的に最大64種類まで拡張することにも挑戦しています。これにより、自然界にはない新たな機能を持つタンパク質の設計・合成を可能とする「人工翻訳システム」の実現を目指しています。このような技術を通じて、次世代のバイオものづくりを切り拓いていきます。
【研究事例 3.2】 新規モダリティ(核酸アプタマー・リボザイム)の開発 新規モダリティとしての核酸アプタマーやリボザイムは、抗体に代わる分子認識ツールや人工酵素として注目されており、次世代バイオ医薬品への応用が期待されています。DNAやRNAは化学修飾の自由度が高く、合成による安定かつ大量な製造が可能で、標的分子に対する高い特異性を備えています。我々は、試験管内で遺伝子配列を連続的に進化させる「Continuous in vitro Evolution」系の構築を通じて、機能性核酸の創出に取り組んでいます。特に、ゲノム編集関連酵素やポリメラーゼといったDNA修飾酵素を特異的に阻害するアプタマー、ならびにRNA配列を連結する新規リボザイムの開発を進め、診断薬の要素技術や次世代シーケンス(NGS)関連ツールへの応用を進めています。さらに、細胞内での安定性と応答制御を可能にする核酸分子の構築や、標的組織へのデリバリー技術の開発にも注力しており、疾患関連遺伝子を精密に制御するための基盤技術として展開を進めています。
尖った研究で、未来を切り拓く
グローバル課題(資源枯渇、環境汚染、人口問題)を解決するためには、化石燃料や化成品に依存しない循環型社会への転換が不可欠です。バイオ分子の特徴(自己組織化、特異的相互作用、環境適合性)は、これらの課題解決の鍵となってきます。さらに局所的な最適化にとどまらず、生命ネットワーク特性(システム協調性、指数関数的増幅、高効率エネルギー転換)を最大限に駆使することが鍵になります。当グループでは、最先端バイオ技術を自ら構築し、学術的な挑戦を通じて新しい知のフロンティアを切り拓いていきたいと考えています。特に、新規農薬や感染症治療薬の開発、抗生物質耐性菌対策、サステナブルバイオ材料分野において「尖った研究」を突き進めて、社会転換の原動力を生み出していきます。
◇業績リスト◇
◇関連トピックス◇
- 企業との成果「PCR作業時に検体の取り違えを防ぐデザイン」
◇技術シーズ紹介◇
◇メンバー◇
| 氏名 | 役職 | 研究テーマ | 研究内容 |
|---|---|---|---|
|
研究グループ長 |
|
創薬(治療薬・診断薬・農薬)に結びつく革新技術を開発を目指し、ゲノム工学・RNA工学・タンパク質工学を基盤に分子ツールを開発します。自動化を志向した研究パイプラインを構築しながら、立体構造情報に基づく合理設計、培養細胞を用いたハイスループット評価、バイオ活性分子の進化工学を実施しています。 |
|
主任研究員 |
|
NMR分光法およびX線結晶解析などの構造生物学的手法により、生体高分子の立体構造決定とそれに基づく分子認識機構の解析を行っています。ウイルス感染症の診断の効率化や創薬加速化のための技術開発を行っています。 |
|
主任研究員 |
|
タンパク質の立体構造の情報は、タンパク質の機能を制御するための改変を導入したり、結合する化合物をデザインするために必須の情報です。タンパク質の立体構造を基にして、タンパク質の産業利用を可能にするような改変をデザインしたり、タンパク質の機能を制御する薬剤設計を行っています。また、構造解析の効率を高めるためAIの利用に取り組んでいます。 |
|
主任研究員 |
|
RNAプロセシングや翻訳制御に関わるタンパク質因子をターゲットとした構造機能解析を実施しています。構造情報に基づいて、阻害剤となる低分子化合物の創出やタンパク質の高機能化を目指した研究を進めています。 |
|
主任研究員 |
|
自然界では、数十万年もの歳月をかけて遺伝子が進化します。しかしその速度は非常に遅く、自然の進化過程では現れなかった可能性が遺伝子には数多く残されています。私は人工的な進化システムを組み込んだ微生物を使って、数週間で遺伝子を思いのままに進化させ、新しい働きや可能性を生み出す研究に取り組んでいます。 |
|
主任研究員 |
|
寄生原虫が引き起こす病気には人獣共通感染症も多く、公衆衛生だけでなく畜産業にも大きな打撃を与えています。ユニークな生態をもつ原虫の細胞プロセスを解明することで、創薬研究の支援や有用酵素のツール化に繋がる知見の創出を目指します。 |
|
研究員 |
|
半屈曲性高分子である長鎖DNAは、細胞内外の環境要因の変化に応答して様々にその大局的な構造を変化させています。私は、蛍光顕微鏡や原子間力顕微鏡(AFM)を用いた長鎖DNAの一分子観察手法を中核として、DNAの高次構造と遺伝子活性の関係について研究を行っています。 |
|
研究員 |
|
ヒト培養細胞にペプチドを提示させ、薬理活性を示すペプチドを探索する系を確立します。また、X線構造解析により、標的分子とペプチドの相互作用を解析します。 |







