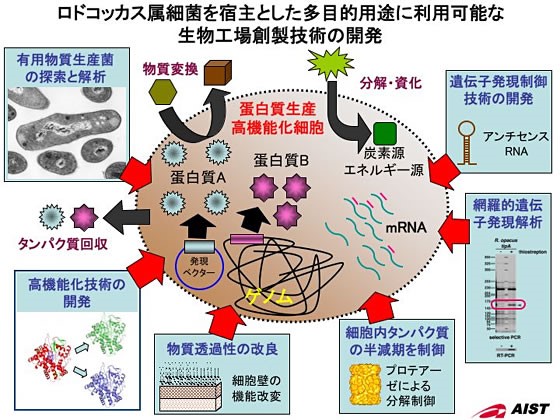
放線菌であるロドコッカス属細菌を宿主とした多目的用途に利用可能な生物工場創製
放線菌であるロドコッカス属細菌を宿主とした多目的用途に利用可能な生物工場創製を目指す研究を中心に、主に以下のような成果が得られています。
1.ロドコッカス属細菌を宿主とした微生物変換技術の開発
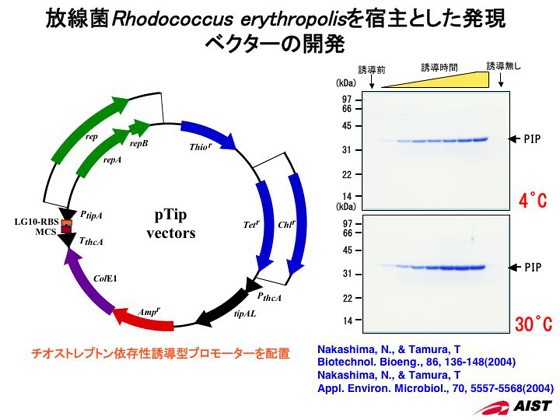
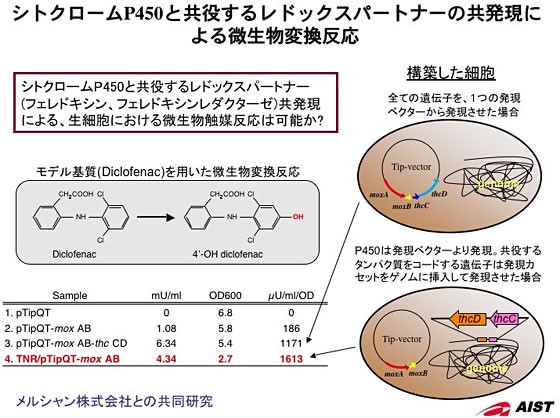
これまで、ロドコッカス属細菌を宿主として組換えタンパク質生産を主目的に、各種発現ベクターの構築を行ってきました。開発したベクターは、ロドコッカス属細菌大腸菌のシャトルベクターであり、ロドコッカス属細菌で自律増殖可能な2種の複製開始起点や複数の抗生剤耐性遺伝子、そして誘導型と構成型のプロモーターを材料に、それぞれを組み合わせることで多種多様な発現ベクターの構築が可能になりました。そしてこれらベクター群を使用することにより、4℃から35℃前後の広範囲な温度域で発現が可能であることを確認すると共に、同一細胞内に単一から複数のタンパク質を共発現することができるようになりました。本発現系を用いて既存の系と比較すると、最も汎用的に用いられている大腸菌を宿主とした系では発現困難な機能タンパク質の発現・精製に成功しました。また、ロドコッカス属細菌に機能タンパク質を蓄積させた高機能型細胞を構築し利用することで、大腸菌では変換困難な物質の生産が可能になり、多様な要求に対応可能なシステムが構築できました。
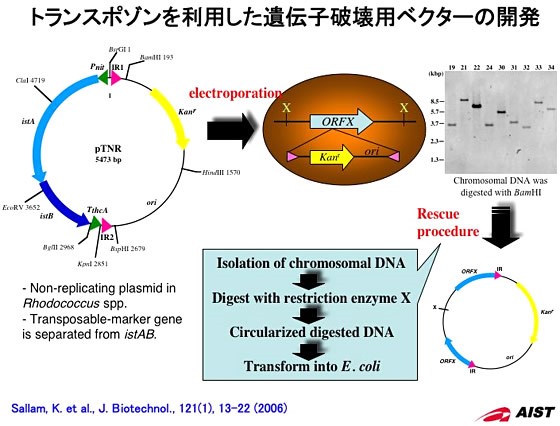
プラスミドを改良した発現ベクターによる組換えタンパク質発現技術に加え、発現ベクターの細胞内不安定性を考慮しなくても済む安定したタンパク質の発現が期待できる系の構築も行いました。通常、宿主細胞に導入した発現ベクターは、抗生剤によるベクター保持菌を選択・ 維持しなければ、ベクターは細胞から抜け落ちていくことがよく知られています。微生物の大量培養による物質生産においては、発現ベクターを保持する細胞を選択・維持するために培地への抗生剤の添加や培養後の培地処理などにおいてコストがかさみます。そこで、トランスポゾンを利用した遺伝子破壊系をまず構築し、トランスポゾンによるゲノムへの遺伝子挿入機構を利用して、任意の遺伝子発現カセット(任意の遺伝子にプロモーターとターミネーターを連結したDNA断片)をゲノムに挿入することで機能タンパク質の発現を可能としました。
トランスポゾンを利用した遺伝子破壊系は、ロドコッカス・エリスロポリス由来IS1415を利用して開発しました。開発したベクターは、ロドコッカス属細菌内では自律増殖できないベクターで、抗生剤耐性遺伝子と大腸菌用クローニングベクターの複製開始起点のみが宿主細胞のゲノムの不特定部位に挿入されるという特徴を持っています。そして、遺伝子破壊された菌からゲノムを精製して処理することで、遺伝子が挿入された周辺領域を含むプラスミドとして大腸菌から回収してくることが可能になりました。このことから本ベクターは、遺伝子が無作為に破壊された細胞のライブラリー構築と破壊部位の容易な同定が可能になり、宿主細胞の機能解析に大きな威力を発揮すると期待されます。
更に、本ベクターによりゲノムへ挿入されるDNA断片に発現カセット(任意の遺伝子にプロモーターとターミネーターを 連結したDNA断片)を導入することで、ゲノムへ直接発現カセットを挿入しタンパク質を発現することに成功しました。この手法を用いることで、発現ベクターの細胞内安定性を考慮せずに安定なタンパク質の発現が期待できるほか、発現ベクターとの併用による多段階の反応を触媒する系の構築が可能になりました。
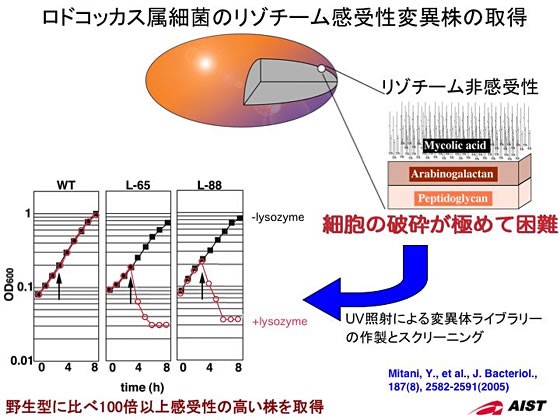
2.リゾチーム感受性株の取得
ロドコッカス属細菌は、ペプチドグリカンとアラビノガラクタンに加え、ミコール酸を加えた3層から成る細胞壁をもつことが知られています。この細胞壁はグラム陽性菌でありながらリゾチーム対して感受性を示さないという特徴を有するため、細胞内に蓄積させたタンパク質を回収するうえで大きな障害となっていました。そこで、ロドコッカス・エリスロポリス細菌にUVを照射して構築した変異体ライブラリーの中から、コロニー個々についてリゾチーム感受性が変化した菌を探索しました。約8500株からのスクリーニングにより、2株のリゾチーム感受性株の単離に成功しました。両感受性株は、野生株に比べてリゾチームに対する感受性が100倍以上高い菌株で、培地中に低濃度のリゾチームを添加することで容易に溶菌することが確認されました。そして、本変異株を組換えタンパク質生産菌として利用することで、細胞内に蓄積したタンパク質の回収効率を著しく高めることに成功しました。
リゾチーム変異株の原因遺伝子を探索・解析すると、ltsAと名付けられたグルタミンアミドトランスフェラーゼのファミリーに属する酵素をコードする遺伝子の機能欠損によって引き起こされることが判明しました。そしてこの遺伝子産物は、ペプチドグリカンの基本骨格を相互にペプチド結合させるにために必要な反応ステップに関与していることを明らかにしました。この酵素は、他の放線菌にも広く保存されており結核菌などのLtsA相同タンパク質も同様の機能を示すことを確認し、LtsAは病原性をもつ放線菌に対する増殖阻害剤を開発する創薬研究の対象として発展する可能性があります。
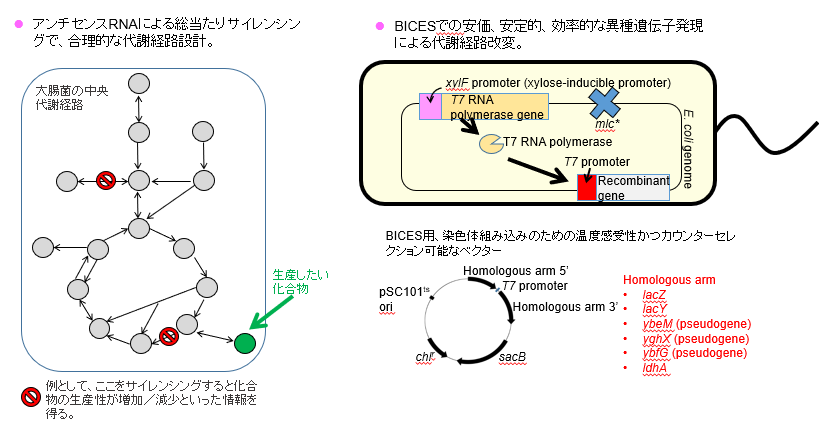
3.大腸菌の代謝経路を「合理的に」設計して、「安価に」改変する
大腸菌などの微生物で工業上有用な化合物を生産することは、旧来の石油依存社会からの脱却と持続発展可能な社会の構築に寄与すると考えられます。しかし、天然のままの大腸菌では有用な化合物を生産できませんので、その代謝経路を人工的に設計し直して、遺伝子工学技術によって改変する必要があります。
まず、代謝経路の設計ですが、従来は研究者の経験と知識に基づいた多大な試行錯誤によって、最適な設計を調べていました。そこで私たちは、もっと合理的に(=無駄な試行錯誤を繰り返すことなく)最適な設計を知るために、アンチセンスRNAを用いた遺伝子サイレンシング法による方法を開発しました。具体的には、中央代謝経路のすべての代謝ステップをサイレンシングするアンチセンスRNA発現ベクター群71個を作成しました。それによる総当たりサイレンシングによって、生産性に重大な影響を及ぼす代謝ステップを合理的に知ることができ、その情報から最適な設計を素早く知ることができました。
次に、最適な設計がわかったら、その設計通りになるよう、代謝遺伝子に改変を施さなくてはいけません。そのために異種遺伝子を導入・発現させることも多くありますが、その発現方法にも工夫を凝らしました。すなわち、大腸菌染色体中に多数の異種遺伝子を挿入することができ、かつ、原材料となるバイオマスに多く含まれているキシロースでそれら多数の異種遺伝子の発現誘導が一斉に起こるシステムを開発しました。これをBICES(Biomass Inducible Chromosome-based Expression System)と呼んでいます。これによって、高価な発現誘導剤(IPTGなど)やプラスミド維持のための抗生物質を使用せずに、長期安定的に異種遺伝子を発現させることができるようになり、その結果、安価にかつ効率よく有用化合物を生産できるようになりました。 以上のような独自の工夫などにより、これまでにアセトイン、2,3ブタンジオール、ピルビン酸、イソブタノールなどを生産することに成功しています。
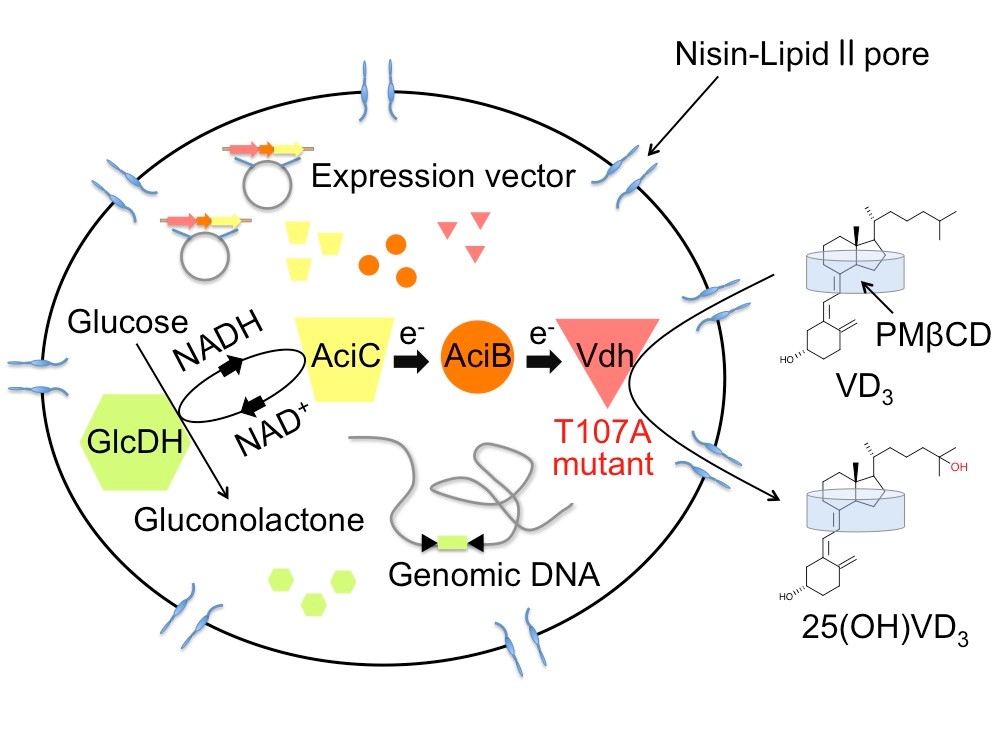
4.ロドコッカス細胞による水酸化ビタミンDの合成
放線菌Pseudonocardia autotrophicaは、ビタミンDを水酸化ビタミンDに変換することができ、この反応を担う酵素がビタミンD水酸化酵素(Vdh)です。水酸化ビタミンDは骨粗鬆症の治療薬等に用いられる物質ですが、有機化学合成の手法では効率良く合成することが困難な物質です。私たちはVdhの結晶構造解析を行い、さらには構造に基づいた変異導入や進化工学的手法により、高いビタミンD水酸化活性を示す変異体を複数取得しました。さらには、Vdh高活性変異体をロドコッカス属細胞で発現させ、ナイシン処理により基質の細胞膜透過効率を向上させる技術を用いることで、非常に高効率に水酸化ビタミンDを合成させることに成功しました。
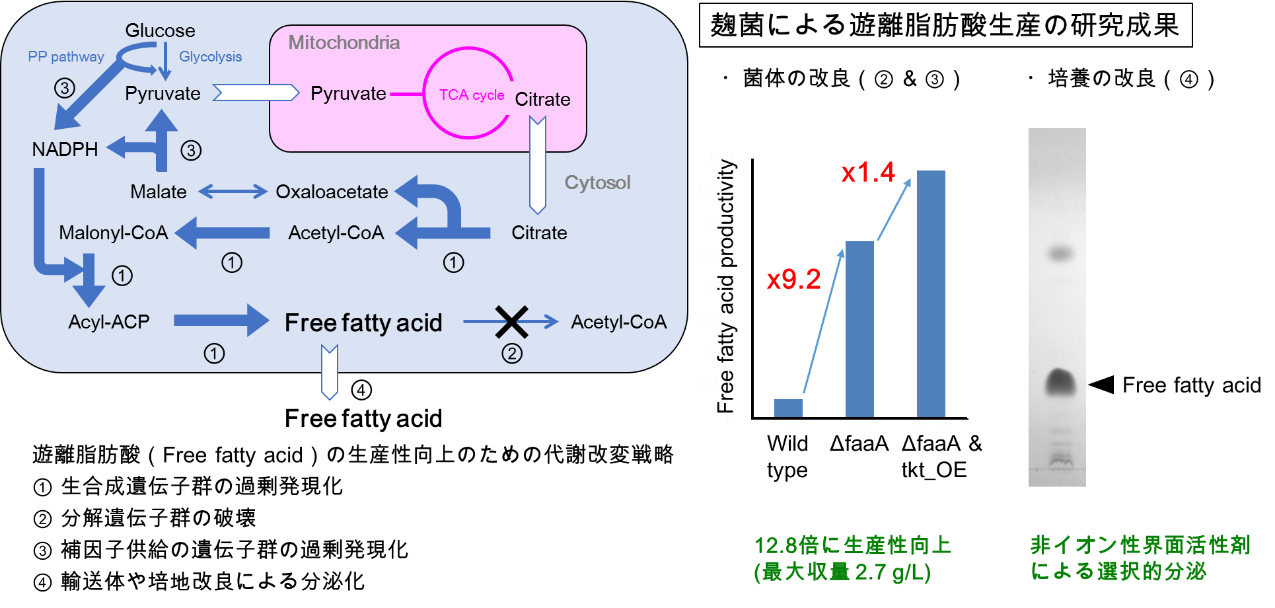
5. 麹菌による遊離脂肪酸の生産量向上と分泌化
遊離脂肪酸は医薬品やバイオ燃料などの原料に利用することが可能です。私たちは、麹菌の脂肪酸代謝を遺伝子組換え技術により改良することで、遊離脂肪酸の生産性を、野生株の12.8倍(生産量では90倍)に大幅に向上させることができました。これは、1リットルの培養液あたり、2.7グラムの遊離脂肪酸生産になります。また、非イオン性界面活性剤を培養液に添加することで、菌の生育を阻害せずに80%以上の遊離脂肪酸を選択的に菌体外に放出させられる現象も発見しました。これにより、手間のかかる菌体破砕を行わずに、遊離脂肪酸を菌体から容易に取り出すことが出来るようになりました。今後は遊離脂肪酸の構造を医薬品等により近い形に改変することで、麹菌の遊離脂肪酸生産に関する技術を産業利用に展開したいと考えております。