微生物や多様な動植物を「視る・知る・操る」をコンセプトに、研究員それぞれが専門分野を持ちつつ、広い生物グループをカバーして研究を展開しています。
微生物の多様な嫌気エネルギー代謝の研究
動植物と比較して微生物は驚くほど多様なエネルギー代謝の多様性を有しており、近年になっても新規代謝系が発見され続けています。当グループでは特に酸素が存在しない嫌気性環境における微生物のエネルギー代謝を対象とした基礎・応用研究を行っています。特に (1)固体導電性物質との電子授受によるエネルギー代謝、(2)金属鉄の腐食に関与するメタン生成、酢酸生成代謝、(3)特に深部地下圏における原油・石炭分解メタン生成代謝、(4)嫌気性廃水処理、(5)金属化合物による原始的微生物代謝の再現、を主要な研究対象としています。
発光生物の発光分子機構の解析
ホタルをはじめとした発光生物に由来する発光タンパク質やその基質等の発光関連因子は、種々のアッセイ系や生体内遺伝子発現のモニタリング等において、有用なツールとして活用されています。一方で、800属超の分類群におよぶ発光生物の大半ではその発光関連因子が依然として不明であり、新たな発光関連因子の発見によるライフサイエンスへの貢献が期待されています。当グループでは、発光生物の新規発光関連因子の探索と機能解明を行うとともに、発光関連因子に着想を得た新しい生体分子の可視化・検出技術の基盤研究も行っています。

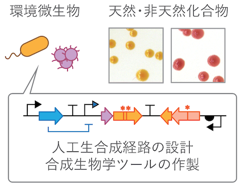
生合成工学による有用化合物の微生物生産
微生物を用いた物質生産は、従来の化石資源を原料とした製法を代替しうる技術として、広く関心が高まっています。なかでも、自然には存在しない人工化合物を生物に作らせる研究にも注目が集められ、その生合成経路を創り出す研究が盛んに行われています。しかし、実験室内で新たに作り出した人工的な新機能・化合物生産能は、それだけでは脆弱で非効率なものが多く、新機能の発展・応用や量産化を行う上でのボトルネックとなっています。私たちは、進化分子工学や合成生物学の技術により、新規化合物への生合成経路をつくるの方法や、その作り出した人工経路をを安定化・強化するための方法に関する研究を行なっています。
インジゴ還元槽の細菌群集構造と機能解析
藍染めの染色液の作成の際に藍の植物体の中に含まれるインジゴを微生物の機能で還元する工程があります。この染色液はアルカリ条件下で生育可能な細菌によって色素還元が起こります。染色の工程はオープンな系で行われるため雑菌汚染が高頻度で起こる条件下で機能が維持されていることになります。藍染めの染色液は、高アルカリでかつ嫌気条件という微生物一般を考えると特殊な環境ですが、その様な制限がかかった環境に多様な微生物が存在しています。本研究では、極限環境下における1)インジゴ還元のための適正な微生物叢形成 2)微生物叢のレジリエンシー機構 3)微生物間相互作用を解明することを目的としています。
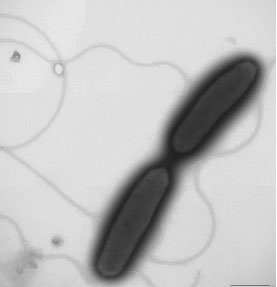

左図: 藍染めの発酵液(pH10以上)から分離されたインジゴ還元細菌Amphibacillus indicideducensN214株(右下のバーは0.5μm).
右図:藍染めの発酵液. 泡のような物体は藍の花と呼ばれている. 表面の光沢は、内部で一度還元されたインジゴが液表面で再び酸化されたもの.
害虫の腸内共生微生物:その機能解析と新規害虫防除技術の開発
多くの動植物はその体内に共生微生物を持ち、緊密な相互作用を行っていることが知られています。近年ヒトマイクロバイオームが注目されていますが、ヒト以外の動物においても腸内微生物叢の多様性と機能解明が急速に進められています。昆虫は100万種以上が報告される陸上最大の生物群ですが、同時に多様な腸内微生物の宝庫です。中でも害虫の多くは発達した腸内共生系を持つことが知られています。これまでの私たちの研究により、これら害虫の腸内微生物は、木質の分解や必須栄養素の供給、代謝老廃物のリサイクリングはもとより、植物が持つ有毒物質の分解、さらには殺虫剤の解毒において重要な役割を果たすことが次々に明らかとなってきました。当グループではこれら害虫体内で重要な役割を果たす腸内微生物に焦点を当て、その多様性と機能を解析するとともに、それら微生物がみせる運動性にも着目し、新規害虫防除法の研究開発に取り組んでいます。
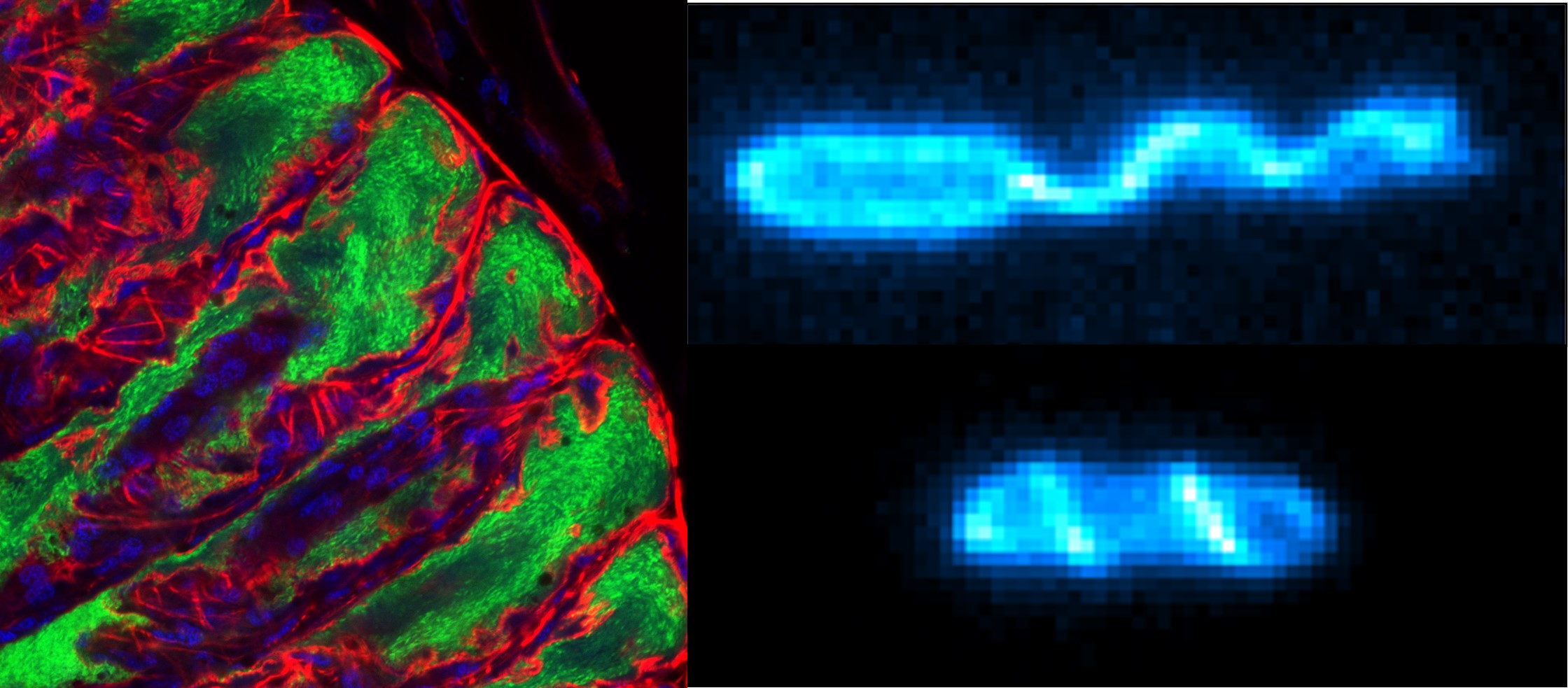
左図: ホソヘリカメムシ消化管に発達する袋状組織(共生器官)の断面図.
腸内共生細菌は緑色で示されている
右図:上段は多くの細菌に見られるべん毛遊泳モード.下段は最近見つかったべん毛ドリル運動モード.