抗体医薬品の品質評価技術の開発
招聘研究員 本田真也
プロジェクト名
- 経済産業省「平成25年度個別化医療に向けた次世代医薬品創出基盤技術開発(国際基準に適合した次世代抗体医薬等の製造技術)」事業 (2013年度)
- 経済産業省「平成26年度次世代治療・診断実現のための創薬基盤技術開発(国際基準に適合した次世代抗体医薬等の製造技術)」事業(2014年度)
- AMED「次世代治療・診断実現のための創薬基盤技術開発(国際基準に適合した次世代抗体医薬等の製造技術)」事業(2015-2017年度)
- AMED「次世代治療・診断実現のための創薬基盤技術開発事業(バイオ医薬品の高度製造技術の開発)」事業(2018-2020年度)
プロジェクト概要
バイオ医薬品製造に関する研究開発エコシステムを構築し、本分野における我が国の産業技術基盤を強化することを目的に、バイオ医薬品原薬の製造に関わる多様な研究開発を総合的に行った。具体的には、宿主細胞、生産細胞株、セルバンク、種培養、生産培養、除細胞、分離精製、ウイルス不活化/除去、品質管理までの全工程を包括する多数の要素技術の開発とこれらを集約融合した総合技術プラットフォームの整備を進めた。
本プロジェクトの実施母体として平成25年9月に設立した次世代バイオ医薬品製造技術研究組合は、複数の企業、大学、公的研究機関等(2020年度の組合員数は48団体)で構成される相互扶助組織(非営利共益法人)である。技術研究組合法のもとで、各組合員は、それぞれの研究者、研究費、施設設備等を持ちより共同研究を行い、得らえた成果は共同で管理し、組合員相互で活用することが基本となる。加えて同技術研究組合は上記の経済産業省/AMED事業を受託し、約550人規模の登録研究者がおおよそ100程度の研究開発課題を分室事業または集中研事業として組織的に実施した。また、その推進にあたっては、非公開の賛助会員制度を設け、将来のユーザーとして想定される製薬会社/CDMOに対し保秘契約のもと開発段階の技術を限定開示し、技術が完成する前でも多様なフィードバックが得られる体制を整えることで、産業界のニーズに即した機敏な研究方針の策定を可能にした。
産業技術総合研究所は、同事業の企画立案から関与し、関係各機関との調整や研究計画の具体化を采配するとともに、同技術研究組合の設立にも協力した。プロジェクト開始後は主に分離精製と品質分析に関する研究開発課題を実施した。担当した部署は、生命工学領域のバイオメディカル研究部門、生物プロセス研究部門、幹細胞工学研究センター(当時)および計量標準領域の計測標準研究部門(当時)、物質計測標準研究部門である。実施した研究開発課題は多岐にわたるが、以下はバイオメディカル研究部門が行ったうちの「高次構造変化に伴う分子不均一性評価技術の開発」と「抗体医薬品の総合的品質分析拠点の構築」について紹介する。
高次構造変化に伴う分子不均一性評価技術の開発
バイオ医薬品は、生体による生合成過程を生産に利用していることから、分子構造上、不均一なものが産生される可能性が本質的に存在する。医薬品の有効成分にこのような分子不均一性が存在することは本来好ましいことではないが、バイオ医薬品では不可避の事象として看過されている。現状でも、厳格な品質管理のもと不均一性のパターンが一定の範囲内に収まるように製造されているが、より安全安心な医療を将来にわたって届けるため、米国食品医薬品局(FDA)は、これらの分子不均一性を評価するための高度な分析技術、分子不均一性を低減するための高度な製造技術を導入し、不均一性に起因する免疫原性惹起等の潜在リスクを極力解消することを製造業者に対し求めている。特に、翻訳後修飾、高次構造および凝集化の3つの特性をFDAは不均一性分析のフロンティアと特定し、研究開発の加速を促している。
高次構造は、この分析フロンティアの一つであり、また医薬品規制調和国際会議(ICH)のガイドラインで推奨されているバイオ医薬品の品質試験項目の一つでもある。しかし、現状は適切な分析技術がないため間接的な手段(生物活性からの推定など)により代替されることが多い。基礎研究用途としては、X線回折法や核磁気共鳴法など、タンパク質の詳細な立体構造情報を提供する分析技術は存在するが、その解析には専門的スキルと長期間の検討を要する。バイオ医薬品の品質試験で常用するには、分解能や精度とともに簡便性や頑健性、迅速性も満足する必要がある。
高次構造が劣化した非天然型構造体は、バイオ医薬品の製造、保管、輸送などの際に生じうる目的物質由来不純物に想定する。これらは自発的に会合し種々のサイズの凝集体を形成することが知られている。凝集体は投薬障害などの物理的な支障のみならず、患者の免疫反応を惹起することに伴う奏効率低下や深刻な有害事象が懸念されている。凝集体に関して、FDAは2014年のガイダンスで以下の対応を推奨している。
- 製造者はバイオ医薬品の中の凝集体の残留を可能な限り最小化すること
- 有効期限の設定では保管中の変性あるいは分解に伴う凝集体の増加を考慮すること
- バイオ医薬品の中の異なる化学種の凝集体をそれぞれ評価するために、選択的で高感度な分析法(または複数の分析法を組み合わせ)を利用すること
- 凝集体の分析法は常に改良し進化させること
- 日常的な出荷試験と安定性試験に適切なアッセイ法を確立し、同等性の確認に利用すること
不純物の分析では特異性と感度も重要になる。共存する大量の目的物質の影響を受けずに、目的物質由来不純物のみを識別する能力が求められる。しかし、高次構造劣化の場合、組成も配列もまったく同一であるため、混入した微量の非天然型構造体を選択的に検出・定量することは非常に難しい。既存のタンパク質分析法では対処できない難問である。これより上述の簡便性、頑健性、迅速性に加えて特異性と感度も備わった新たな分析法の登場が望まれている。
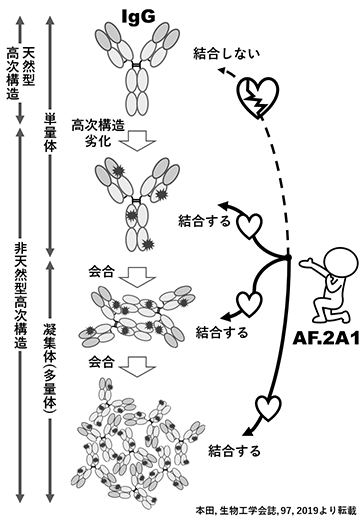 以上の背景に鑑み、産総研バイオメディカル研究部門は、バイオ医薬品の高次構造変化に伴う分子不均一性評価技術の開発を実施した。研究開発の経緯は省略するが、紆余曲折の末、免疫グロブリンG(IgG)に結合性を有する人工タンパク質AF.2A1の開発に成功し、このAF.2A1をリガンドとして利用した抗体医薬品の非天然型構造体の新規分析法を構築した。
以上の背景に鑑み、産総研バイオメディカル研究部門は、バイオ医薬品の高次構造変化に伴う分子不均一性評価技術の開発を実施した。研究開発の経緯は省略するが、紆余曲折の末、免疫グロブリンG(IgG)に結合性を有する人工タンパク質AF.2A1の開発に成功し、このAF.2A1をリガンドとして利用した抗体医薬品の非天然型構造体の新規分析法を構築した。
AF.2A1は25アミノ酸残基で構成される微小な人工タンパク質で、物理的・化学的ストレスによって天然型高次構造が劣化したIgGに対してのみ特異的に結合する(左図)。しかし、天然型のIgGには親和性を示さない。IgGに結合するタンパク質は複数知られているものの、このような高次構造劣化を選択的に認識する分子はまれである。このAF.2A1の稀有な性質は、非天然型高次構造(すなわち異常型)が微量混入した際の不純物分析にブレークスルーをもたらす。主な性能は下表の通りである。開発した技術は、抗体医薬品開発の様々な用途、すなわち、特性解析、安定性試験、品質管理、工程管理、および生産法開発での利用が期待される。
- 【論文】
- Yageta S, Lauer T, Trout B, Honda S "Conformational and Colloidal Stabilities of Isolated Constant Domains of Human Immunoglobulin G and Their Impact on Antibody Aggregation under Acidic Conditions" Molecular Pharmaceutics, 12(5), 1443-1455 (2015).
- Imamura H, Honda S "Kinetics of Antibody Aggregation at Neutral pH and Ambient Temperatures Triggered by Temporal Exposure to Acid" Journal of Physical Chemistry B, 120 (36), 9581-9589 (2016).
- Watanabe H, Yageta S, Imamura H, Honda S "Biosensing Probe for Quality Control Monitoring of the Structural Integrity of Therapeutic Antibodies", Analytical Chemistry, 88 (20), 10095-10101 (2016).
- Senga Y, Imamura H, Miyafusa T, Watanabe H, Honda S, “AlphaScreen-based homogeneous assay using a pair of 25-residue artificial proteins for high-throughput analysis of non-native IgG”, Scientific Reports, 7(1), 12466 (2017).
- Imamura H, Honda S, “Calibration-free concentration analysis for an analyte prone to self-association” Analytical Biochemistry, 516, 61-64 (2017).
- Imamura H, Sasaki A, Honda S, “Fate of a stressed therapeutic antibody tracked by fluorescence correlation spectroscopy: Folded monomers survive aggregation”, Journal of Physical Chemistry B, 121(34), 8085-8093 (2017).
- Yageta S, Shibuya R, Imamura H, Honda S "Conformational and Colloidal Stabilities of Human Immunoglobulin G Fc and Its Cyclized Variant: Independent and Compensatory Participation of Domains in Aggregation of Multidomain Proteins" Molecular Pharmaceutics, 14(3):699-711 (2017).
- Senga Y, Honda S, “Suppression of aggregation of therapeutic monoclonal antibodies during storage by removal of aggregation precursors using a specific adsorbent of non-native IgG conformers” Bioconjugate Chemistry, 29(10), 3250-3261 (2018).
- Imamura H, Honda S. “pH-shift stress on antibodies” Methods in Enzymology 622, 329-345 (2019).
- Fukuda N, Senga Y, Honda S, “Anxa2‐ and Ctsd‐knockout CHO cell lines to diminish the risk of contamination with host cell proteins” Biotechnology Progress 34(4), e2820 (2019).
- Senga Y, Imamura H, Ogura T, Honda S, “In-Solution Microscopic Imaging of Fractal Aggregates of a Stressed Therapeutic Antibody”, Analytical Chemistry, 91(7), 4640-4648 (2019).
- Yageta S, Imamura H., Shibuya R., Honda S. “CH2 domain orientation of human immunoglobulin G in solution: Structural comparison of glycosylated and aglycosylated Fc regions using small-angle X-ray scattering” mAbs, 11(3), 453-462 (2019).
- Senga Y, Ogura T, Imamura H, Honda S, “Nano-Microscopy of Therapeutic Antibody Aggregates in Solution” in Houen G ed. Therapeutic Antibodies: Methods and Protocols (Methods in Molecular Biology, vol 2313), Springer US, in press (2021).
- Miyafusa T, Watanabe H, Honda S, “Local disorder of the C-terminal segment of the heavy chain as a common sign of stressed antibodies evidenced with a peptide affinity probe specific to non-native IgG”, International Journal of Biological Macromolecules, 182, 1697-1703 (2021). 【総説】
- 今村比呂志、渡邊秀樹、千賀由佳子、本田真也「バイオ医薬品におけるタンパク質凝集体の評価」、『タンパク質のアモルファス凝集と溶解性―基礎研究からバイオ産業・創薬研究への応用まで―』、pp29-43、シーエムシー (2019).
- 今村比呂志、本田真也「抗体の凝集メカニズム:スモルコフスキー凝集速度式によるモデリング」、生物物理, 59(3), 147-150 (2019).
- 本田真也「抗体医薬品の高次構造の健全性を評価する技術」、生物工学会誌, 97, 406-409 (2019). 【特許】
- 抗体結合性ペプチド:特許6363022号(日本),US9605029(米国),GB2949750(英国)
- 微小タンパク質の骨格構造に基づく分子ライブラリ:特許5904565号(日本),9897611(米国),GB2940197(英国)
- 非天然型立体構造を形成した抗体に親和性を示すポリペプチド:特許6818305号(日本)
- ポリペプチドの凝集化抑制方法:US10941179B2(米国) 【プレスリリース】
- 抗体の凝集体を選択的に除去し、保管中の凝集体発生を抑制する技術 -抗体医薬品の保存安定性の向上に貢献- (2018.9.28)
- 液中のナノメートルサイズの抗体凝集体を観察 -抗体医薬品の凝集化メカニズムの解明が前進- (2019.3.28)
抗体医薬品の総合的品質分析拠点の構築
「再現性の危機」が案じられている。少し前になるが、2016年にNature誌は衝撃的なレポートを掲載した。1500名を超える科学者にアンケート調査を行ったところ、70%以が他者の研究の再現に失敗したことがあると回答した。そして、50%以上がなんと自らの実験結果の再現にも失敗した経験を有していた。科学論文の再現性が危機的な状況にあると答えた科学者は半数を超えていた。
産総研バイオメディカル研究部門は経産省/AMED事業「国際基準に適合した次世代抗体医薬等の製造技術」を分担するにあたり、抗体の品質分析を総合的に行う評価ラボを設置し、分析項目の選定、分析装置の導入、操作担当者の教育訓練、標準試料の設定、分析条件の最適化、分析法バリデーションの実施、標準作業手順書改訂の立案改訂等を継続的に進め、再現性・信頼性の優れた品質分析のための環境と体制の構築に取り組んだ。これは、上記の「再現性の危機」に鑑み、同技術研究組合が開発した新たな製造技術の有用性を保証するためには、新技術を用いて製造された生産物の品質を実際の医薬品原薬とみなして再現性・信頼性の優れた環境と体制で適正かつ詳細に分析し、その品質が同等以上であることを保証することが不可欠であると判断したことに因る。
整備した分析法は約50項目に及ぶ。ICHガイドラインに則り、「構造」としてアミノ酸配列、スルフヒドリル基、単糖組成、糖鎖結合部位、糖鎖プロファイルなど、「物理化学的性質」として分子量、等電点、電気泳動パターン、クロマトグラフィーパターン、高次構造など、「純度・不純物・混入物」として凝集体割合、電荷異性体割合、サイズバリアント割合、N末グルタミン酸の環化、C末リシンの欠失、メチオニンの酸化、アスパラギンの脱アミド化、漏出プロテインA、残留DNA、残留HCP、エンドトキシン、不溶性微粒子などを整備した。医薬品の管理に関する具体的な手順等は各製造業者のノウハウであり、通常秘匿され公開されることはない。私たちの目的は公的プロジェクトの研究開発成果の検証であったが、バイオ医薬品の承認申請に必須である品質特性の分析法を包括的かつ体系的に整備した経験は希少と思われることから、得られた知見はこの分野に関心をもつアカデミア、バイオベンチャー、新規参入の異業種企業等においても参考になるものと考えている。成果の一例を以下に示す。なお、バイオメディカル研究部門では、抗体医薬品の品質分析技術に関する研究協力や技術コンサルタントを行っています。ご関心のある方はお問い合わせください。
-
【論文】
- 絹見朋也、野田尚宏、本田真也「モノクローナル抗体溶液の吸光度測定における研究室間比較」、生物工学会誌,99(1), 23-28 (2021). 【総説】
- 本田真也「バイオ医薬品の品質分析技術の課題と展望(前編)」、ファームテックジャパン, 30(12), 2349-2355 (2014).
- 本田真也「バイオ医薬品の品質分析技術の課題と展望(後編)」、ファームテックジャパン, 30(13), 2557-2560 (2014).
- 本田真也、今村比呂志、渡邊秀樹、宮房孝光「第4回 分光学的性質を利用してタンパク質の構造を知る」【連載】バイオ医薬品の分析のコツ―品質評価のための基礎と応用、ファームテックジャパン, 33(14), 2959-2965 (2017).
- 本田真也、宮房孝光、今村比呂志、渡邊秀樹、大石郁子「第8回 タンパク質の安定性分析と安定化設計(前編)」【連載】バイオ医薬品の分析のコツ―品質評価のための基礎と応用、ファームテックジャパン, 34(3), 555-564 (2018).
- 本田真也、宮房孝光、今村比呂志、渡邊秀樹、大石郁子 「第9回 タンパク質の安定性分析と安定化設計(後編)」【連載】バイオ医薬品の分析のコツ―品質評価のための基礎と応用、ファームテックジャパン, 34(5), 885-894 (2018).
- 本田真也、千賀由佳子、今村比呂志、野田尚宏、宮房孝光、渡邊秀樹「第12回 バイオ医薬品に含まれる不純物」【連載】バイオ医薬品の分析のコツ―品質評価のための基礎と応用、ファームテックジャパン, 34(9), 1865-1877 (2018).
- 本田真也「バイオ医薬品の製造と品質管理 —バイオシミラーのより良い理解のために—」、ファルマシア, 54(4), 325-329 (2018).
- 本田真也「MABプロジェクト総括「先進的品質評価技術の開発」」、ファームテックジャパン, 34(14), 2964-2971 (2018).
- 本田真也「分科会4「先進的品質評価技術の開発」概要」、生物工学会誌, 97, 404-405 (2019).