セルロース材料グループでは、「作る」「知る」「使う」のサイクルで研究開発を進めています。
〒739-0046 広島県東広島市鏡山3-11-32
国立研究開発法人 産業技術総合研究所
中国センター 機能化学研究部門

バイオエタノール製造のためのナノセルロース製造CONCEPT
最近、バイオエタノールが再注目されてきた理由は、自動車用燃料としての利用に加えて、航空機のジェット燃料(SAF: Sustainable Aviation Fuel)としての利用からです。ジェット燃料(炭化水素類、性状としては灯油に類似)をバイオマスから製造する方法としては、植物油の変換とともに、バイオエタノール(あるいはバイオブタノール等)をエチレンに変換してジェット燃料にする方法などが注目されています。 SDGs推進のためには、木材のような再生型資源の高度利活用が大切です。
さらに、コロナ禍での消毒用アルコールとして、身近なセルロース系廃材を利用した糖化・発酵によるバイオエタノール製造、高付加価値化を目指した、木材等を原料とする飲料用のバイオエタノール、つまり「お酒」の製造も関心を集めています。

※注意:エタノールの製造は、法律で規制がかかる場合があります。自由に製造・販売等をすることはできません。
木材からのバイオエタノールには、メリットもあればデメリットもあります。メリットは、言うまでも無く二酸化炭素を吸収した木材から製造できることです。しかし、木材は強靱で、バイオエタノールの元となるセルロース等を最初にグルコース(ブドウ糖)などに分解するところにコストがかかります。また、木材は、薄く・広く存在しているため、原料の収集・運搬も最終的な製品コストに大きく影響します。
本ページでは、酵素を用いてセルロースをグルコースに変換させるプロセスを中心に解説しています。
ナノセルロースを基盤とするバイオエタノール製造のための前処理技術
~産総研開発技術のまとめ~
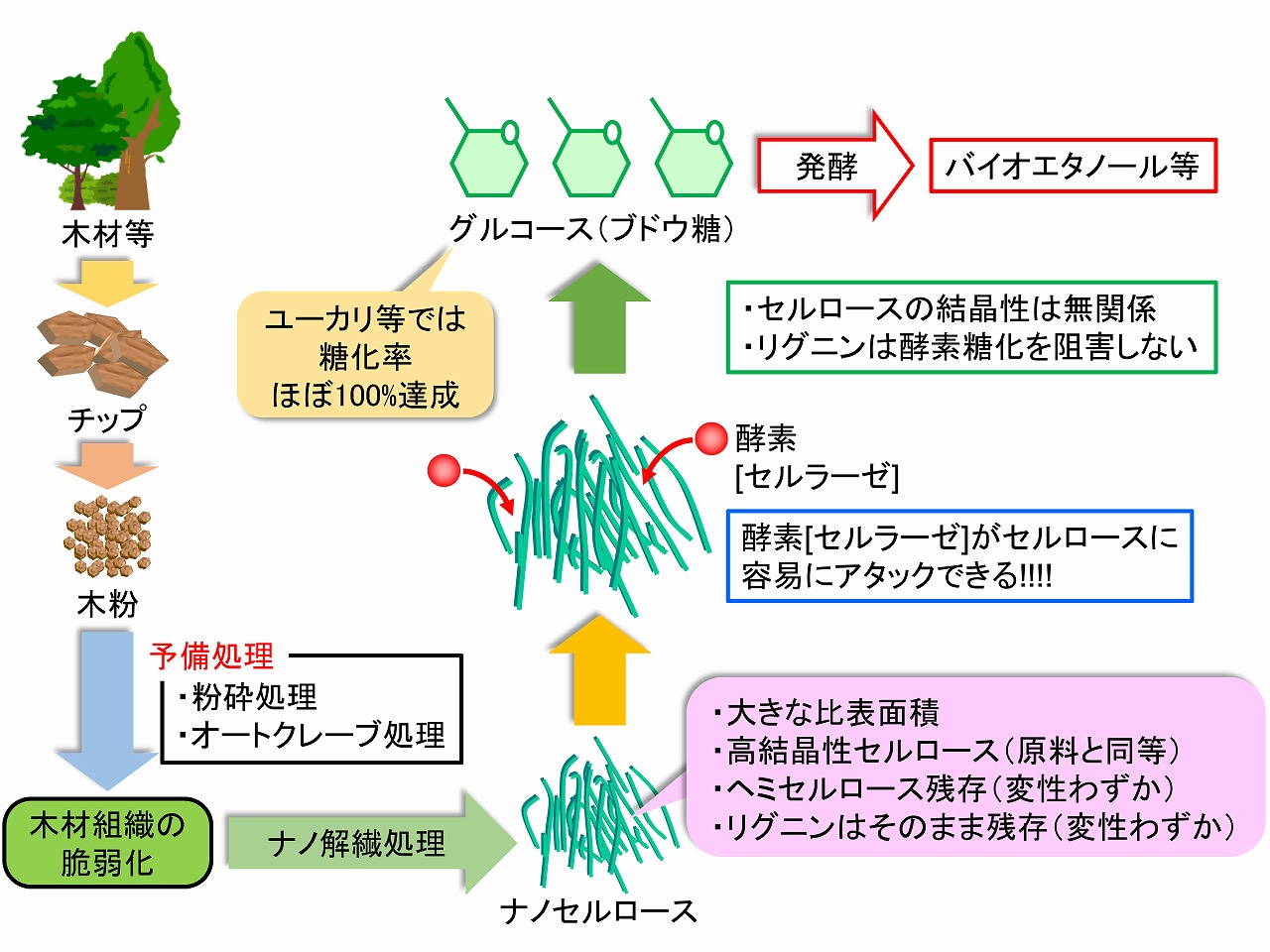
本ページでは、効率的にバイオエタノールを製造するための前処理として、木材等のバイオマス原料からナノセルロース(セルロースナノファイバー/CNF)を製造し、酵素(セルラーゼ)が接触できる面積を最大化して、酵素糖化性を向上させる当研究グループが開発した技術を紹介しています。木材の酵素糖化技術は、古くから研究開発が行われていますが、当研究グループで開発した技術では基本的に、セルロースの結晶性は酵素糖化に影響しない、リグニンも酵素糖化の阻害物質ではないことを明らかにしています。下図に開発技術の概要をまとめています。このプロセスを用いるとことで、ユーカリ等の広葉樹では、酵素糖化率はほぼ100%にすることができました。これら結果を導くに至った、要素技術は、次項で順次説明しています。
我々が開発した技術は、セルロース等の木材成分の酵素反応メカニズム解析に基づいた成果であり、最も単純かつ無理が無いプロセスと考えています。
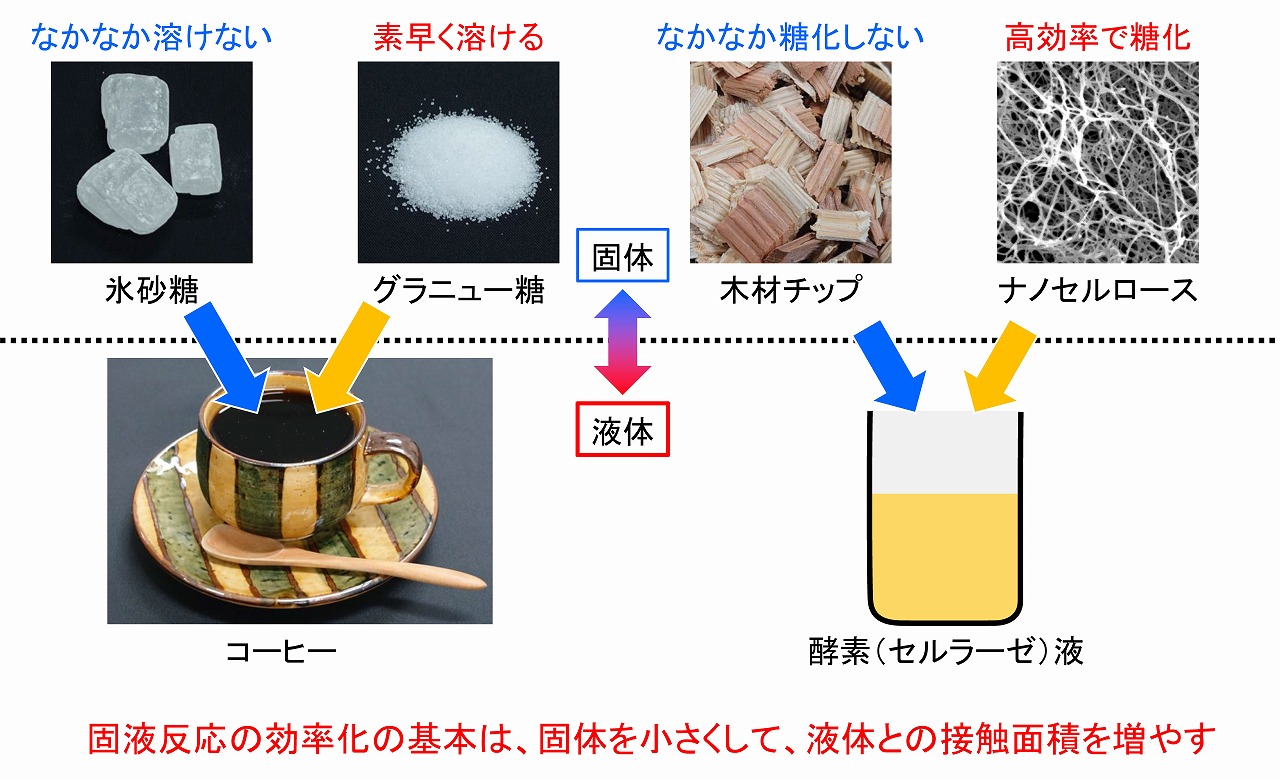
下図には、コーヒーに砂糖を入れて溶かす時のイメージ図を載せています。氷砂糖とグラニュー糖では、溶けるスピードが異なることは、容易に理解できると思います。糖化酵素であるセルラーゼは水(実験的には緩衝液など)に溶けていますが(厳密にはナノ分散)、酵素糖化したいセルロース原料は固体です。固体と液体の反応、固液反応を効率化する、最も単純な方法は、固体をできる限り小さくして、液体との接触面積を増やすことです。木材等の酵素糖化でも、ナノセルロースにして固体であるセルロース成分の表面積を大きくすると、水に溶けているセルラーゼ等の糖化酵素との接触面積も大きくなり、酵素糖化は効果的かつ効率的に進行します。
酵素糖化の時の、酵素の反応メカニズムは、木材成分である、セルロース、ヘミセルロース、リグニンの状態に影響されます。詳細は、本ページ後半の「ナノセルロースの表面特性と酵素糖化性」に記載していますが、セルロースを酵素糖化するためには、最初に、その表面のヘミセルロースを糖化することが重要です。リグニンは、最も外側に存在していると考えられますが、糖化酵素では分解等はできません。しかし、リグニンは、セルロースやヘミセルロースの表面を全面的に覆っているわけではないため、ヘミセルロースやセルロースを糖化すると、自然と遊離してくると考えられます。ただ、リグニンはヘミセルロースと特別な共有結合でつながっているため、その部分のヘミセルロースは、立体的障害や基質特異性から完全には糖化しにくいと考えられます。実際、十分に酵素糖化した後の残渣では、リグニンとともにヘミセルロース由来の糖が検出(硫酸加水分解法での糖定量から)されます。完全糖化であれば、リグニンのみとなるはずですが、ヘミセルロースが少し残る事例が多く観察されています。
コーヒーに砂糖を入れる場面から酵素糖化をイメージ
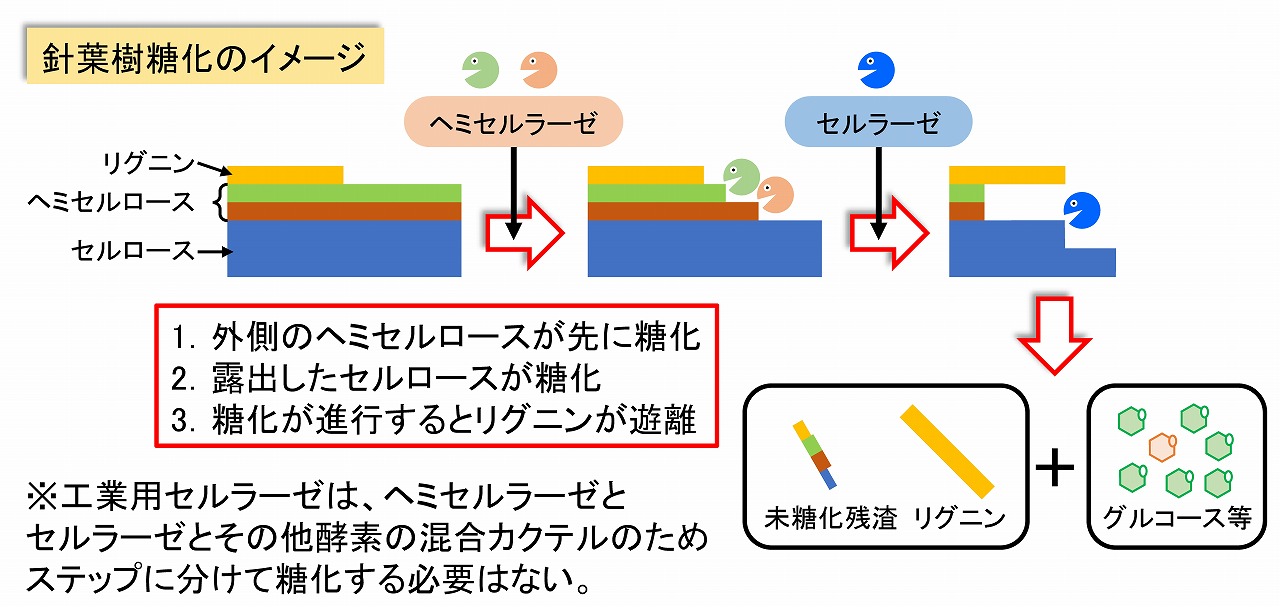
木材成分を酵素糖化する場合の順番イメージ
1.特許第5206947号「微細繊維状セルロース系物質及びその製造方法」登録 ( H25/03/01 ),遠藤貴士,李 承桓,寺本好邦,田中紀子,角谷直美,特願2008-086559,特開2008-274247
2.「微細繊維状セルロース系物質及びその製造方法(Fine fibrous cellulosic material and process for producing the same)」,米国・特許No.8900410 B2, 登録2014年12月2日.遠藤貴士,李承桓,寺本好邦,新谷紀子,角谷直美.
3.特許第5339250 号「酵素液の製造方法及び糖の製造方法」登録 ( H25/08/16 ),秀野晃大,井上 宏之,澤山 茂樹,塚原 建一郎,遠藤貴士,特願2009-155326,特開2010-051308
4.特許第5880827号「セルロースナノ繊維の製造方法」登録 ( H28/02/12 ),李 承桓,Kim Han-Woo,石川一彦,遠藤貴士,特願特願2011-258118,特開2013-110987
5.特許第5915979号「微細繊維状セルロースの製造方法」登録 ( H28/04/15 ),遠藤貴士,三浦豊和,李 承桓,特願特願2012-040751,特開2012-193353
6.特許第5995239号「水晶振動子微量天秤用バイオセンサー及びその製造方法」登録 ( H28/09/02 ),熊谷明夫,李 承桓,遠藤貴士,特願特願2013-064400,特開2014-190744
◇参考文献:
・遠藤貴士、シンセシオロジー、2(4) 、310-320 (2009). 「バイオ燃料を木材からナノテクで生産する」(外部リンク)
・NEDO報告書、「セルロース系エタノール革新的生産システム開発事業・事業原簿【公開】」(外部リンク
「※早生樹からのメカノケミカルパルピング前処理によるエタノール一貫生産システムの開発」の項参照
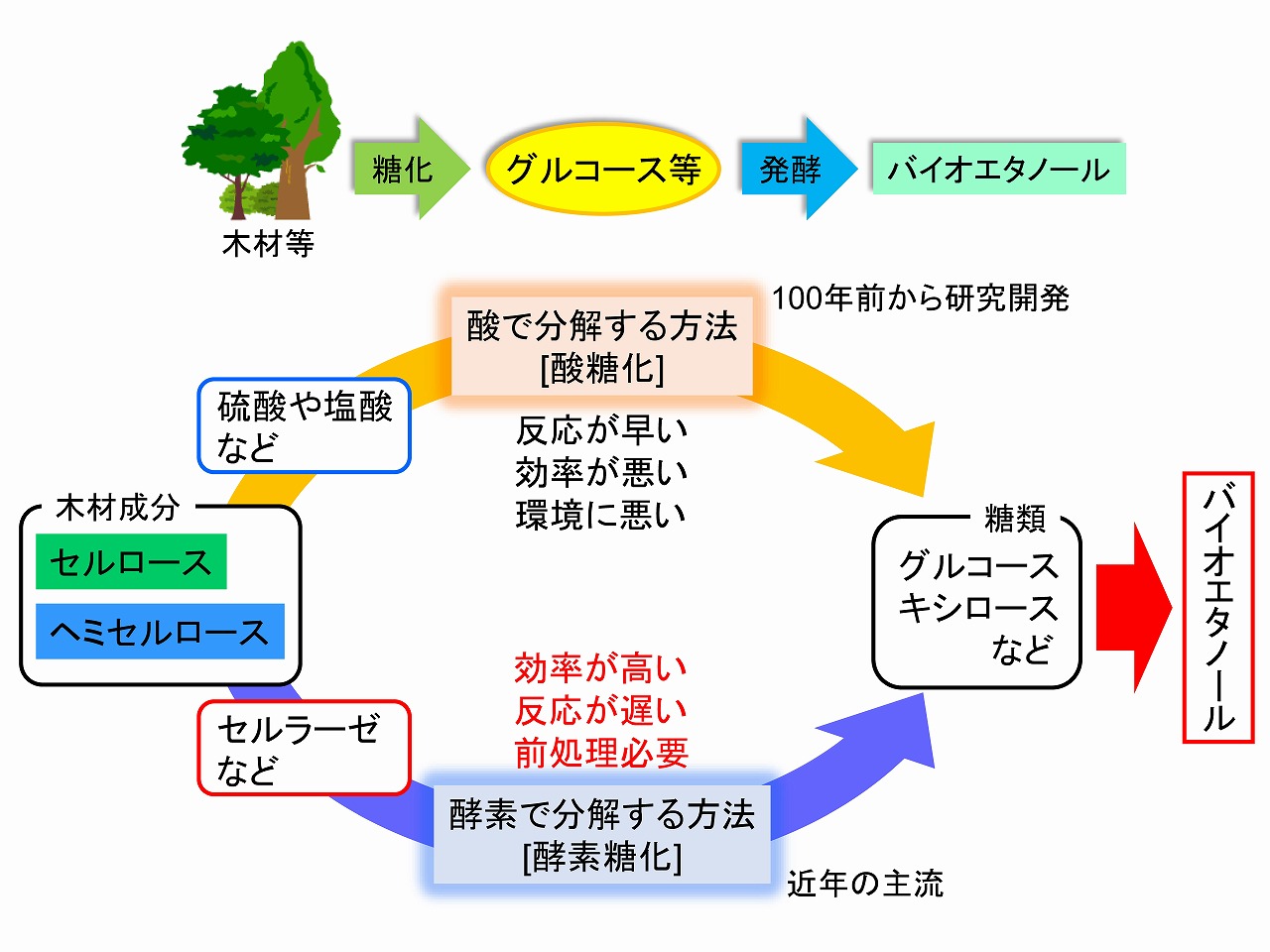
バイオエタノールの概要
■地球温暖化対策、二酸化炭素排出量削減、再生型資源の高度利用などから、10年以上前にバイオエタノールブームがありました。想定される主用途は、自動車用の燃料です。しかし、バイオエタノールは、アメリカやブラジルでは実用化されていますが、原料は、トウモロコシ由来のデンプンやサトウキビ由来の糖(ショ糖)です。これらは食品としても利用されていることから、食品との競合も起きることが課題とされていました。
■そこで、食べることができない木材や草本などの非可食原料からのバイオエタノール製造に関する研究開発が世界中で加速しました。木材系原料からのバイオエタノール製造は、実際には、100年以上前から取り組みがありました。100年前は世界情勢が不安定で大戦等もあり、燃料や食料品の輸出入の課題から、自国資源の活用が進められました。木材は、多くの国・地域で簡単に入手できることから、これらを燃料や食料品に変換する技術開発が注目されました。
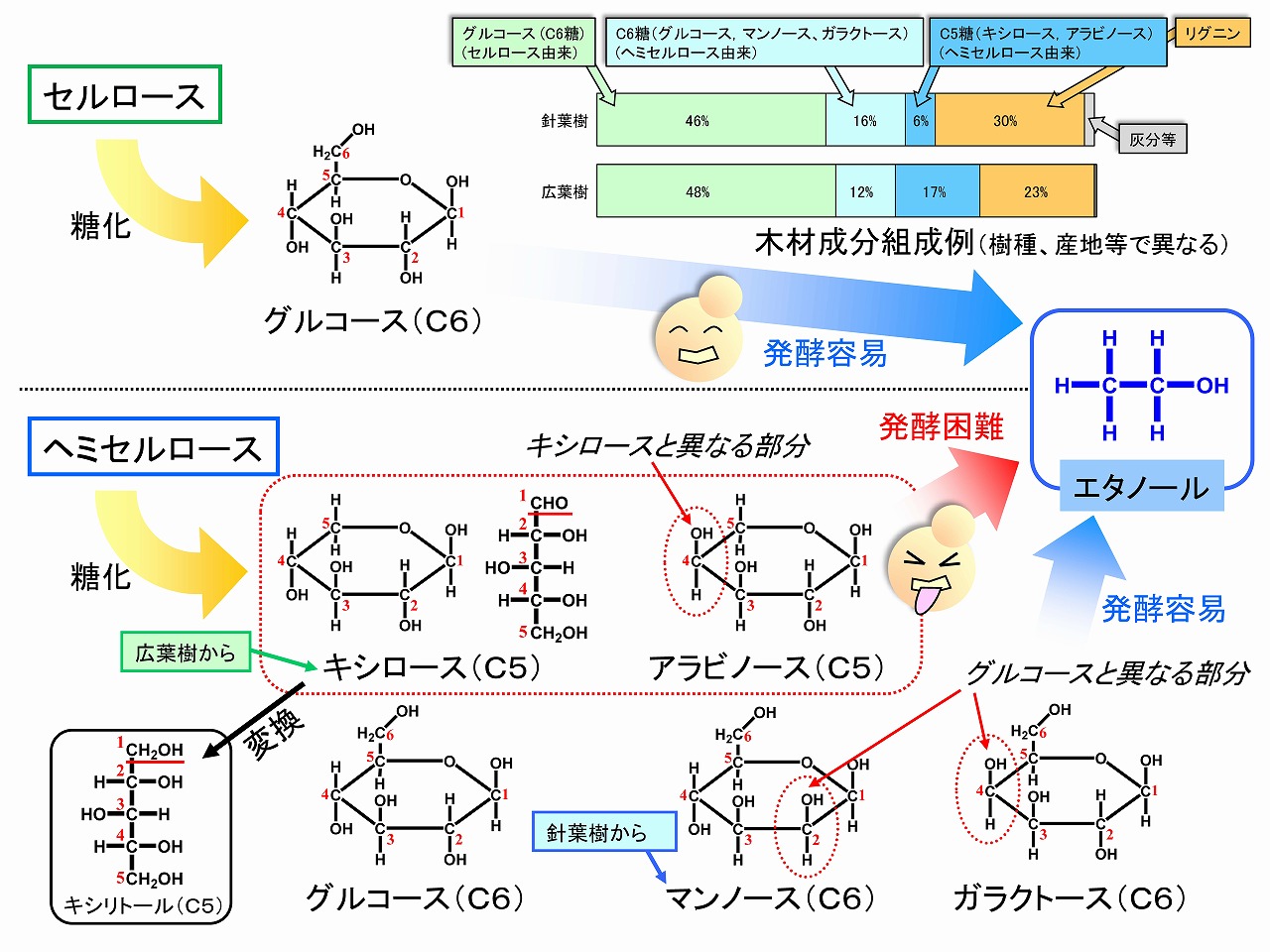
■木材,草,竹,稲ワラ等の植物の主要成分は,セルロース,ヘミセルロース,リグニンです。これらの中で、セルロースとヘミセルロースは、分子が糖で構成されており、特にセルロースは加水分解すると、グルコース(ブドウ糖)が得られます。デンプンも加水分解するとグルコースが得られます。これらの反応は、糖化と呼ばれています。グルコースは、酵母菌で代謝すると、エタノール(バイオエタノール)に変換することができます。お酒はまさにグルコースをエタノール(バイオエタノール)に変換して製造されています。ヘミセルロースからは、通常の酵母菌ではエタノール変換しにくいキシロース等の炭素数5個の糖(グルコースは炭素数6個)が生成しますが、このことは本ページの最後の項で解説します。
木材からのグルース等の糖類は、微生物等の発酵原料に用いることができるため、エタノール以外にも様々な化学品に変換することも可能となります。ただし、木材からの糖化液は、様々な物質を含んでいるため、微生物の種類によっては、増殖が進まない等の発酵阻害で化学品への変換効率も低下する場合はあります。
■デンプンはアミラーゼ等の酵素で比較的簡単にエタノールに変換できますが、木材中のセルロースは安定であり、加水分解するためには工夫が必要です。これまでに、セルロースを糖化(加水分解)する方法として、主要な方法は、酸による糖化方法と酵素(セルロースを糖化する酵素はセルラーゼ)による糖化法が知られています。
■酸糖化では、コストが安く反応が早い、硫酸が使用されるプロセスが主流です。木材糖化では、100年前も硫酸糖化法が用いられていました。しかし、分解しすぎてしまう過分解による収率低下や反応制御の難しさ、設備・装置の硫酸耐性の問題が指摘されていました。そのため、セルラーゼを用いる温和で高収率の酵素糖化法の研究が活発になりました。
■酵素糖化は、硫酸糖化と比較すると、糖化反応が遅く、硫酸に比べてセルラーゼは高コストであり、少ないセルラーゼで高効率かつ速く糖化させること、あるいはセルラーゼの回収・再利用が重要とされていました。そのため、原料となる木材等の前処理(セルラーゼの反応性を向上させる処理)が課題となっていました。
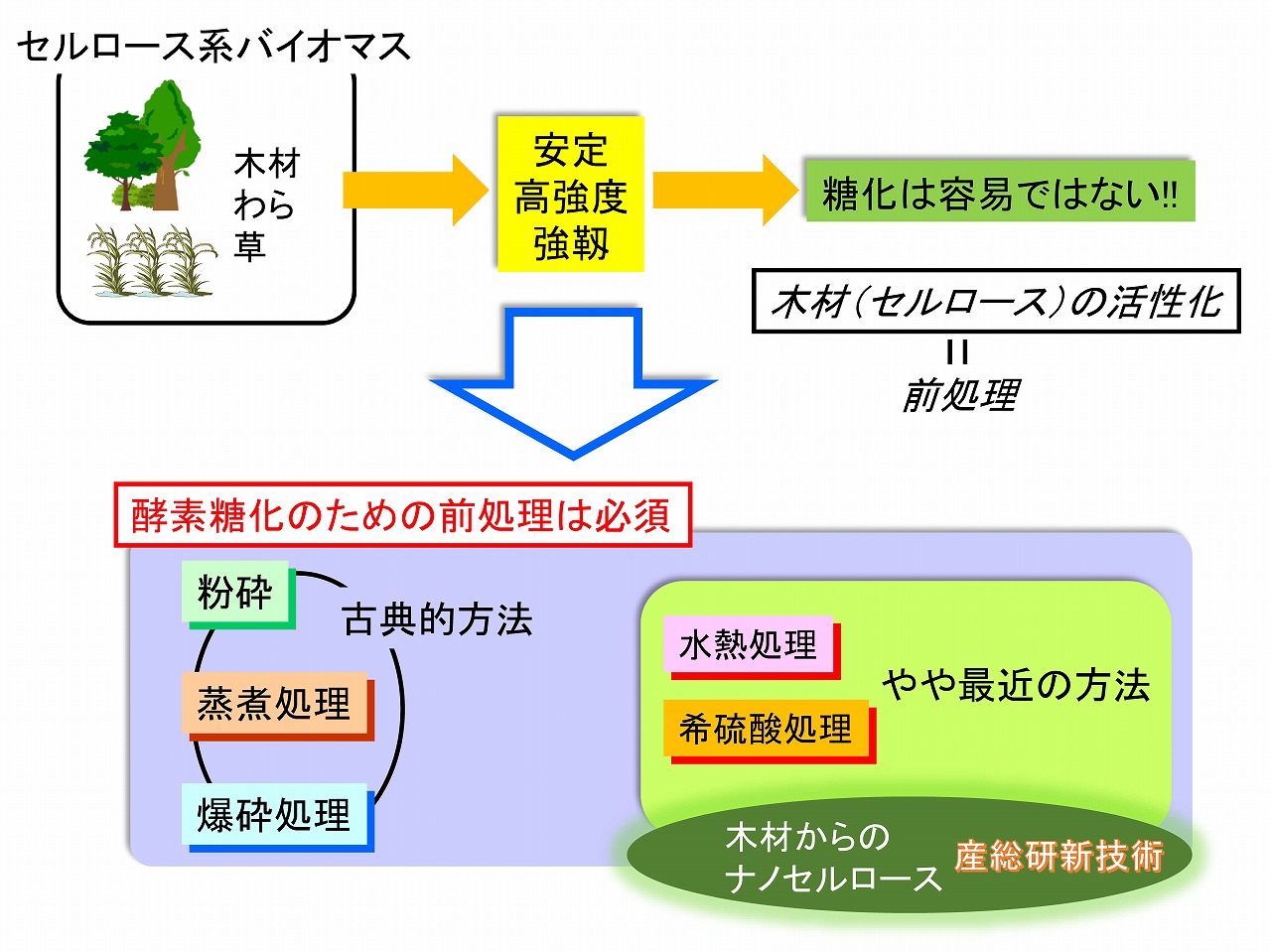
酵素糖化のための前処理の重要性
■木材等のセルロース系バイオマスの酵素糖化も、研究開発としては長い歴史を持っています。目的は、バイオエタノールのような燃料と、サトウキビ等を経ないグルコースの製造です。しかし、木材組織は安定かつ強靱なためセルラーゼで酵素糖化するためには、反応性を向上させる前処理技術が重要です。
■木材の主要成分は、セルロース、ヘミセルロース、およびリグニンです。前述のように、セルロースとヘミセルロースは分子が糖で構成されているため、糖化すれば発酵プロセスでエタール(バイオエタノール)に変換できます。リグニンは、芳香族化合物であり、簡単にはエタノールに変換できません。
■木材成分中、セルロースは50%近い割合があり、この糖化がバイオエタノール製造では重要となります。セルロースは結晶構造を持っていますが(ナノセルロース(セルロースナノファイバー/CNF)の基本のセルロースミクロフィブリル)、このセルロースの結晶性が酵素糖化を阻害していると考えられています。また、芳香族化合物であるリグニンが酵素糖化を阻害しているとも言われています。しかし、当研究グループの基盤研究から、セルロースの結晶性やリグニンの存在は、セルロースの酵素糖化性には基本的には無関係であること明らかにしています。
■酵素糖化のためには木材等の原料の前処理が重要ですが、その方法としては、粉砕処理、水熱処理(100℃以上の加圧熱水処理)、爆砕処理、蒸煮処理、希硫酸処理などが知られています。これらの処理の目的は、強靱な木材組織を破壊して、セルロースの反応性を向上させることにあります。これは、強靱な木材組織を解繊してナノセルロースを製造することとコンセプトは同じです。
■上記の前処理を行うと、木材の酵素糖化性は向上する事例は多く報告されています。しかし、酵素糖化における、セルロースとセルラーゼの反応メカニズムを考えた場合、必ずしも正攻法とは言えない場合があります。酵素糖化性を向上させる最も重要なポイントは、加水分解酵素であるセルラーゼがどれだけセルロースに接近して、移動しながら糖化できるかに掛かっています。これは、アクセシティビリティという考え方です。
■前処理としての粉砕処理(乾式)では、セルロースの結晶性は低下しますが、その結晶性低下が直接的な理由ではなく、木材組織が崩れていくことで、セルラーゼのセルロースへのアクセシティビリティが向上して酵素糖化性も向上します。水熱処理や希硫酸処理でも、ヘミセルロースが加水分解し、木材組織が多孔質化あるいは崩れて、酵素糖化性が向上します。爆砕処理、蒸煮処理もメカニズムは同じです。
■セルラーゼのセルロースへのアクセシティビリティを向上させることを基本とすると、単純に考えて、木材中のセルロース成分の表面積を大きくすれば良いことが分かります。つまり、木材をナノセルロースにすれば酵素糖化性は向上することになります。実際、セルロースの酵素糖化性と比表面積は高い相関性が確認されています。詳細は、次項で解説します。
■セルラーゼには色々な種類がありますが、大別すると結晶性セルロースを加水分解するエキソ型(プロセッシブ型)と非晶性セルロースを加水分解するエンド型(ノンプロセッシブ型)があります。さらに、セルラーゼは酵素としては比較的大きなタンパク質であり、そのサイズは、セルロースミクロフィブリル(最小サイズのナノセルロース)と同程度とされています。エキソ型セルラーゼは、セロビオハイドロラーゼ(CBH)とも呼ばれています。
このエキソ型酵素は、分子鎖が揃ったセルロースの結晶部分を認識して取り付き、分子鎖の上を線路の上を走る列車の様に移動しながら、活性部位に分子鎖を引き入れて加水分解します。(生成物は、グルコース2個が、β1,4結合でつながったセロビオースです。そのため、グルコースに加水分解するβ-グルコシダーゼが必要です。※)
エンド型セルラーゼ(EG)は、セルロースの非晶部分に取り付き、セルロース分子の結合を切断(加水分解)後、離れてまた別の位置に移動して、結合を切断します。そのため、生成物は、セルロースのオリゴ糖になります。
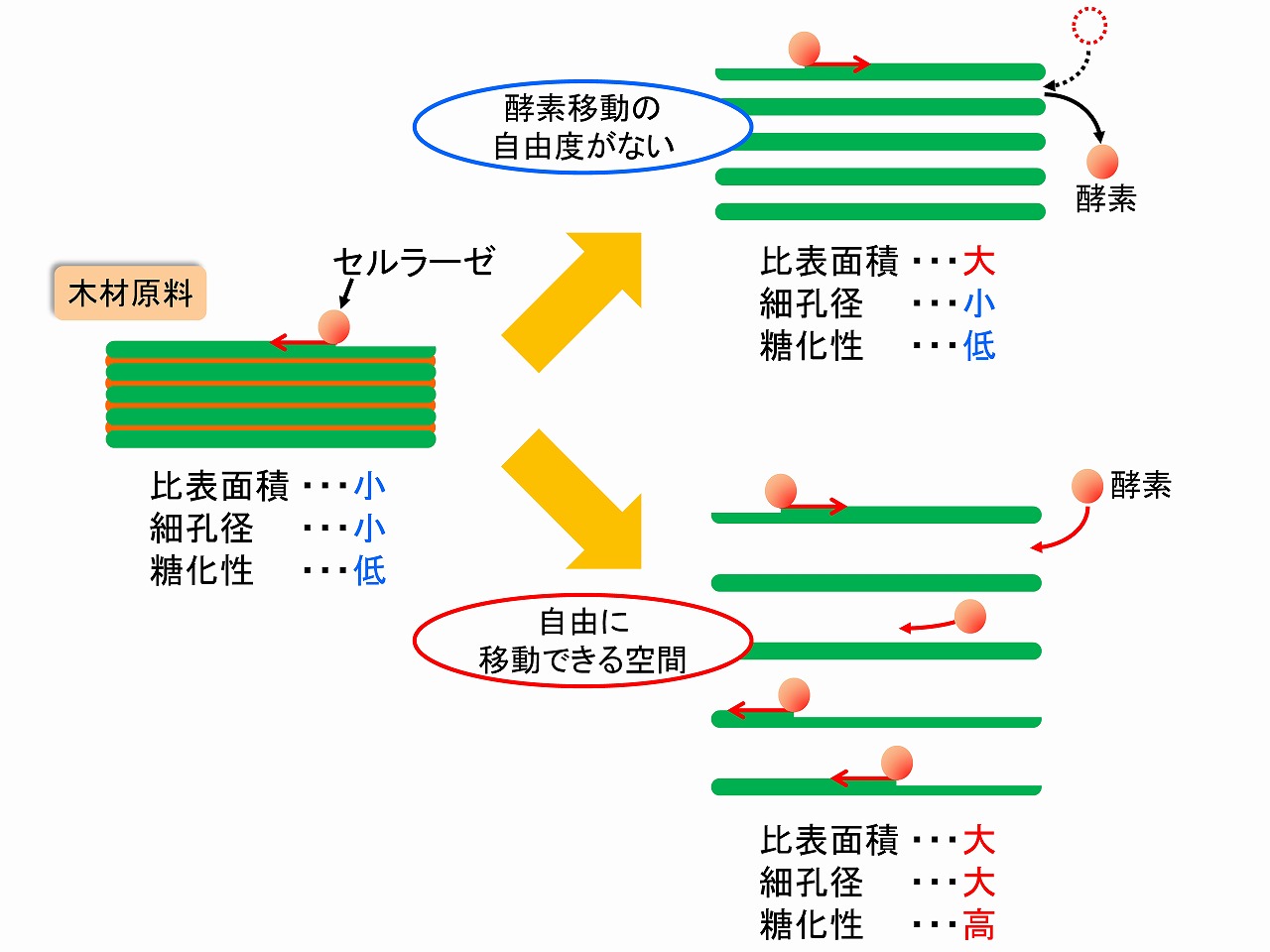
セルラーゼによるセルロースの加水分解では、セルラーゼが移動する自由度、つまり、セルロース(実際には、セルロースミクロフィブリル)の周りにセルラーゼが活動できる空間が必要です。セルロースミクロフィブリルはナノセルロース(セルロースナノファイバー/CNF)の基本です。
※セルラーゼは、セルロース等を加水分解する酵素群の総称です。通常、工業的には、様々な酵素が混合した酵素カクテルが利用されています。原料に応じたセルラーゼ、ヘミセルラーゼ、β-グルコシダーゼなどのミックスレシピが糖化率向上にはとても重要です。
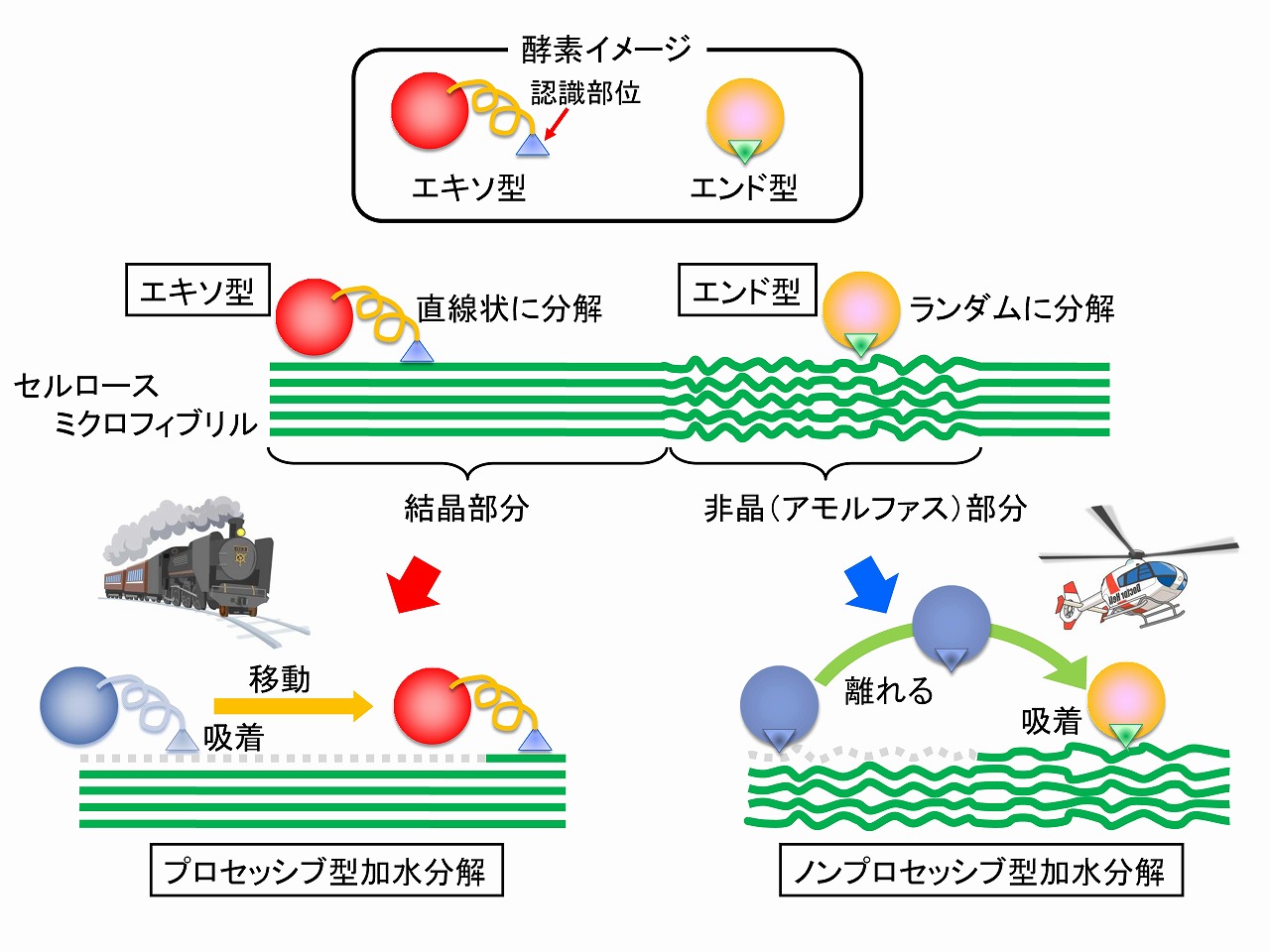
セルラーゼの酵素糖化メカニズムの概要
◇参考文献:
セルロース学会編、「セルロースの事典」、朝倉書店、東京(2008.4.20)
木材組織とナノセルロース製造の基本
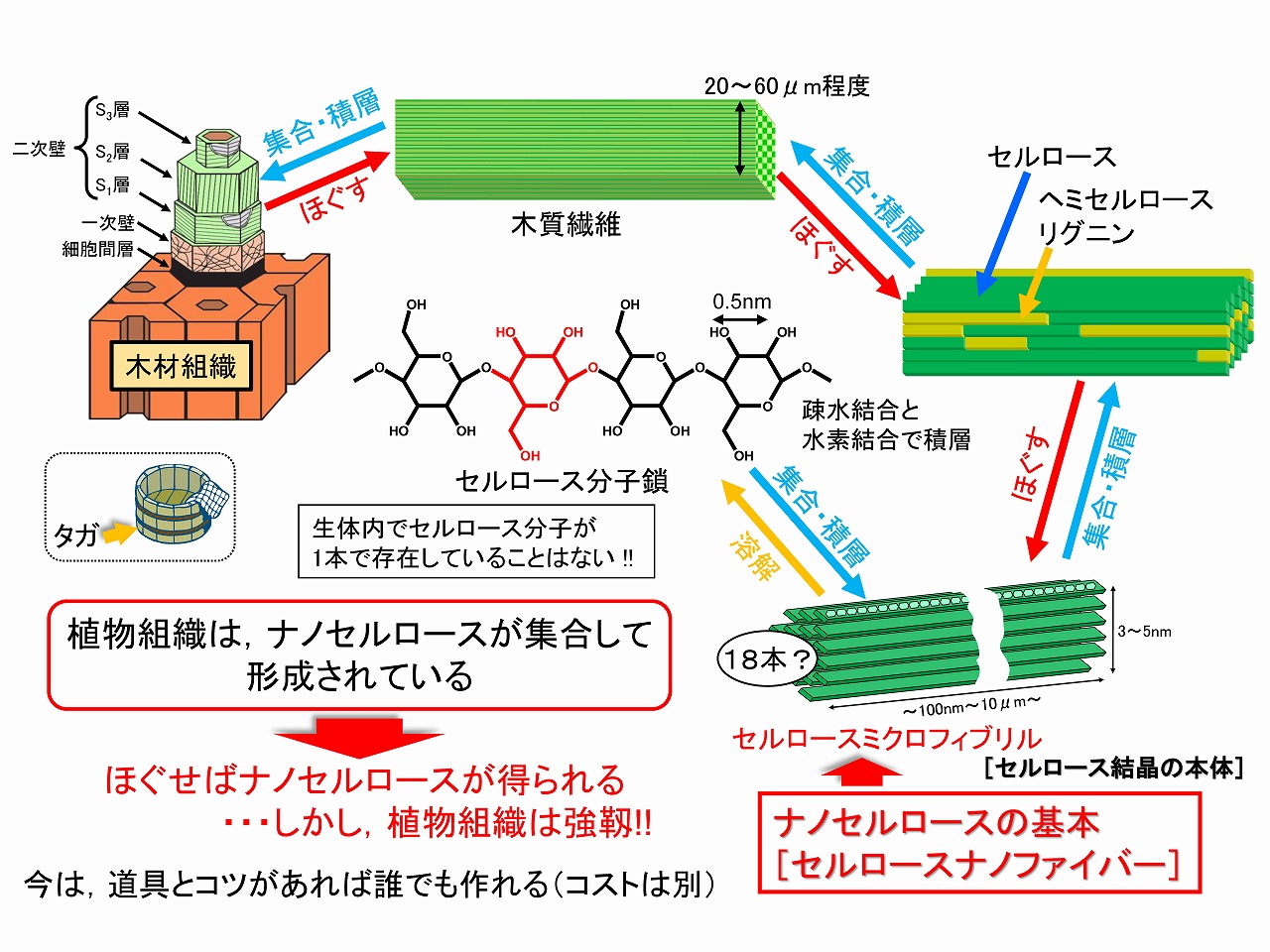
木材からのバイオエタノール製造のための前処理として、ナノセルロース(セルロースナノファイバー/CNF)製造が重要と回折してきましたが、ナノセルロースは、基本的に全ての植物系原料から製造することができます。植物内で生合成されたセルロース分子は、直ちに規則正しく自己集合して、セルロースミクロフィブリルと呼ばれる幅3nm程度の超微細繊維を形成します。このミクロフィブリルがナノセルロースの基本です。TEMPO触媒酸化法で製造されるナノセルロース(シングルセルロースナノファイバー)が約3nmとなるのはこのためです。木材の主要成分中、セルロースは結晶性を示しますが、このセルロース分子が規則正しく集合したミクロフィブリルが結晶構造の本体です。
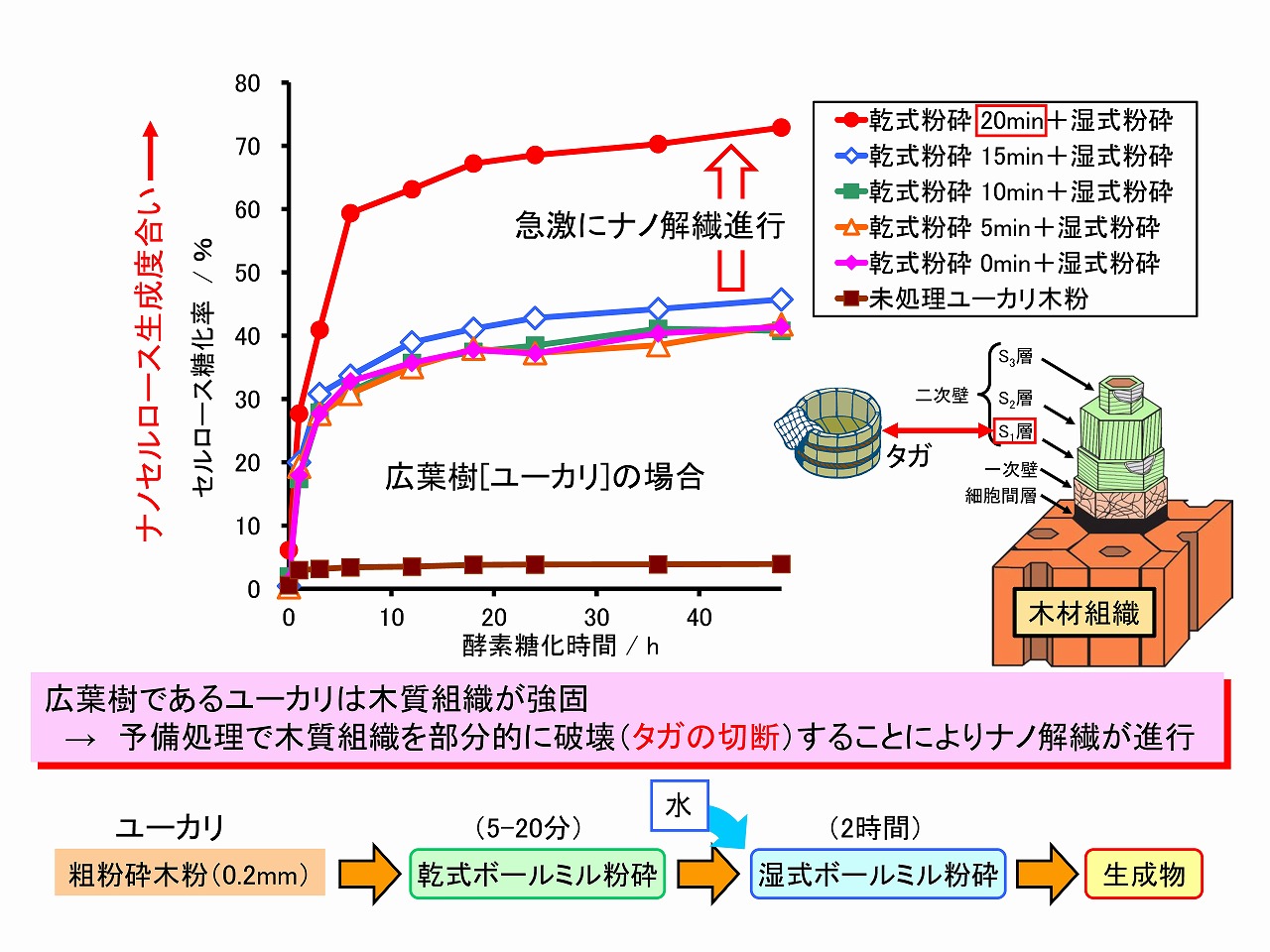
木材組織では、ミクロフィブリルがヘミセルロースやリグニンを接着剤のようにして、主に水素結合や分子間力により集合・積層して細胞壁を形成しています。そのため、基本的には、細胞壁構造をほぐせばナノセルロースが製造できます。しかし、木材は、古くから建材としても利用されているように、強靱であり、容易にはほぐされない構造を持っています。植物細胞壁は、外側から細胞間層、一次壁、二次壁で構成されており、二次壁が最も厚く、さらに大きく3層(S1,S2,S3)に分かれています。二次壁の各層では、ミクロフィブリルが規則正しく並んでいますが、各層での配向方向が異なっています。S1層は、内側の積層構造を縛り付けた、桶や樽のタガ類似の作用をしており、これら構造やヘミセルロース等の接着作用が木材の強靱さの発現にも寄与しています。下図に木材細胞壁構造の形成モデル図を示しました。
前述のように木材組織をほぐしてナノセルロース(セルロースナノファイバー/CNF)を製造するためには、細胞壁を部分的にでも破壊する必要があります。細胞壁二次壁のS1層など、細胞壁の緻密な積層構造が強靱化要因であるため、この部分を破壊すればナノセルロースの製造効率は大きく向上するはずです。下図に、原料木材(ユーカリ木粉)を、先に処理時間を変えて乾式ボールミル粉砕し、次いで水に分散させて湿式ボールミル処理によりナノ解繊を行い、酵素糖化率を調べた結果を示しています。20分間、乾式ボールミル粉砕した後に、急激にナノ解繊が進行し、酵素糖化率が大きく向上しています。この結果は、ナノセルロース製造前に、木材組織を部分的にでも破壊しておくことが、極めて重要であることを示しています。
木材からのナノセルロース製造を難しくする強靱化要因は、細胞壁の積層構造とヘミセルロース等の接着作用と考えられますが、製紙用パルプでは、これらの強靱化要因がパルプ化工程で除かれているため、ナノセルロースは比較的簡単に製造できます。
◇参考ページ:
1. 「技術のポイント」-「簡単な?ナノセルロースの作り方。」
2. 「研究紹介」-「ナノセルロースの一般的製造方法(概要)」
ナノセルロースの酵素糖化性
バイオエタノール製造のため酵素糖化の前処理として、木材から直接的にナノセルロース(セルロースナノファイバー/CNF)を製造するためには、いくつかの処理の組み合わせが重要です。木材組織の強靱さがナノ解繊のネックとなっています。効率的に木材をナノ解繊するためには、木材細胞壁のセルロースミクロフィブリルの積層構造とセルロースミクロフィブリル同士を接着しいるヘミセルロース等の作用を取り除くあるいは脆弱化する必要があります。細胞壁の構造を弱める処理としては、数百ミクロン程度までの粉砕処理等で十分です。また、ヘミセルロースは130~140℃程度から加水分解するため、高温タイプの滅菌用オートクレーブ処理(水熱処理)で、部分的(10%程度でも効果あり)に加水分解することができます。このオートクレーブ処理では、リグニンは数%しか分解せず、変質もわずかで、ほぼ原料と類似の状態で残存しています。
下図は、木材から直接的にナノセルロースを製造するプロセスの組み合わせと酵素糖化性の関係を示しています。湿式高速カッターミル処理では、細胞壁構造が部分的に破壊されます(木材細胞壁の二次壁のS1層の破壊が重要)。次いで、135℃のオートクレーブ処理では、ヘミセルロースが部分的に加水分解します。この処理の組み合わせで、木材組織は脆弱化します。最終段階で、湿式ディスクミル処理することでナノセルロースが効率的に製造でき、酵素糖化率も大きく向上します。
これらの条件で得られたナノセルロースは、原料木材と同等のセルロース結晶性を維持しており、原木材と同程度の割合でリグニンも残存しています。しかし、酵素糖化性は高い値を示しています。これらのことから、酵素糖化性とセルロースの結晶性およびリグニンの存在は、酵素糖化性には、基本的に無関係と結論付けています。リグニンは酵素糖化の阻害物質ではありませんが、過酷な前処理(例えば、160℃以上での水熱処理等)を実施すると、リグニンは変質して阻害物質に変化します。このことは、水晶振動子マイクロバランス法を用いた精密な酵素糖化メカニズム解析から明らかにしています(次項で解説)。
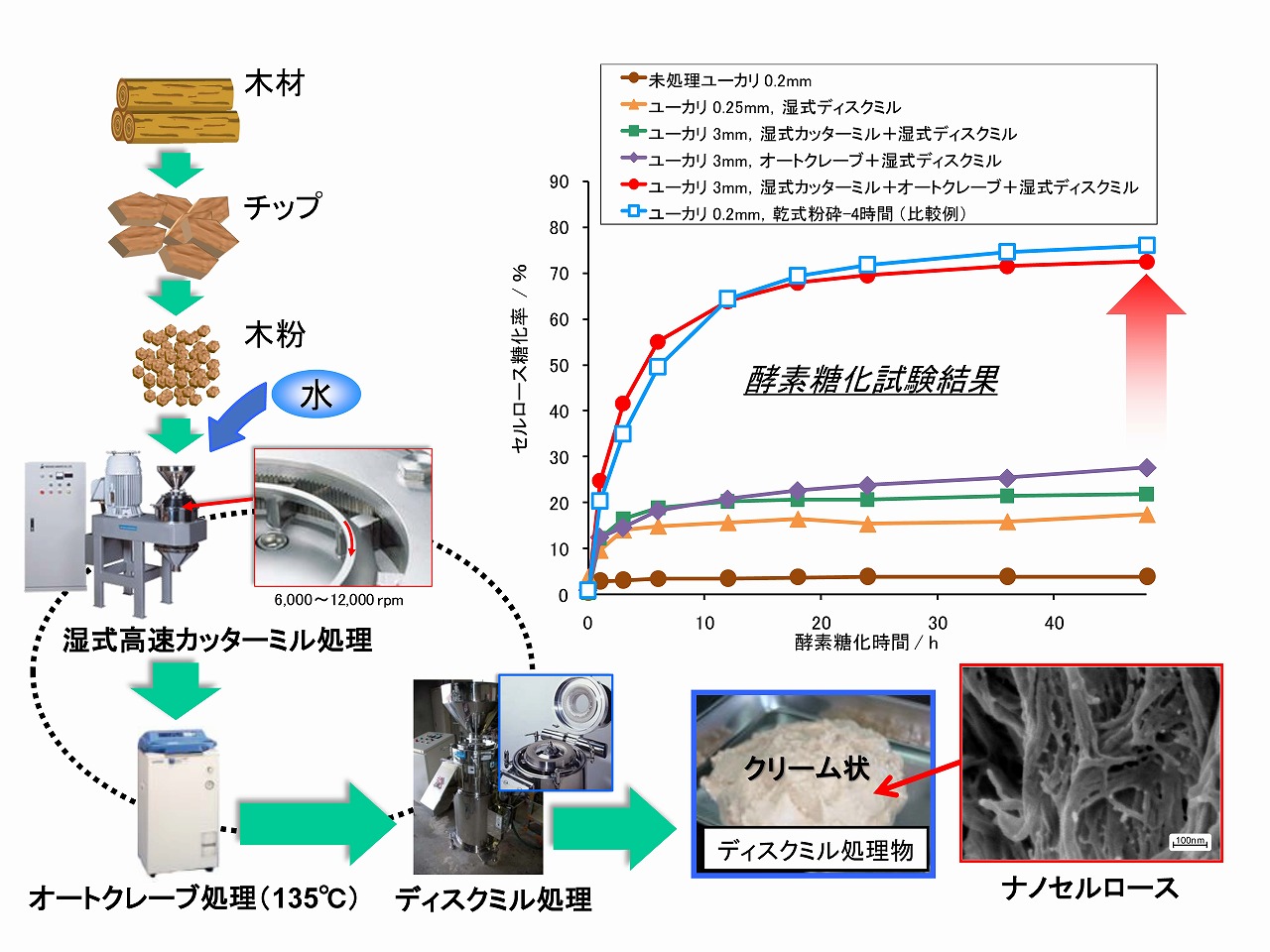
前処理プロセスの組み合わせと酵素糖化率の関係
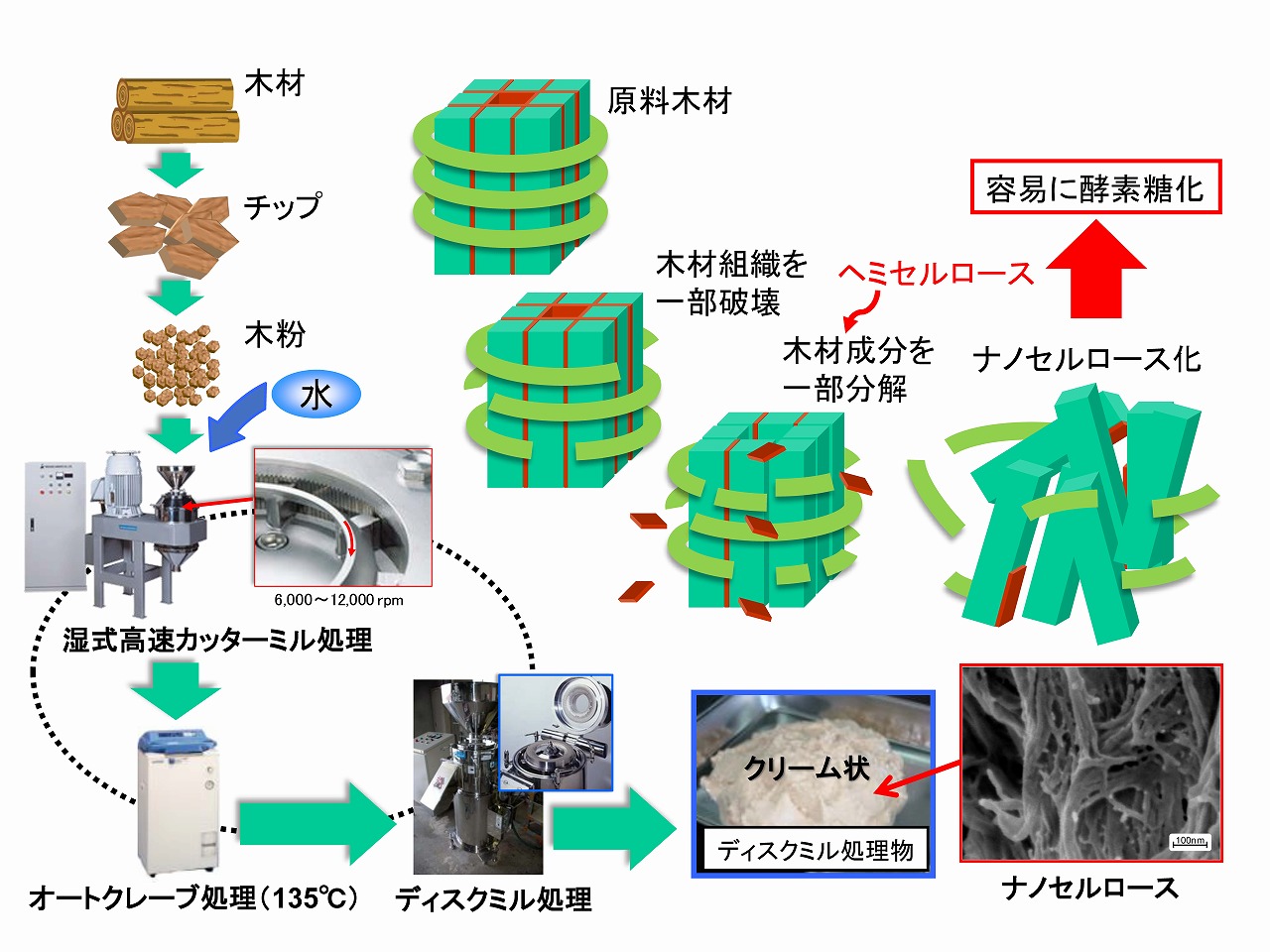
前処理プロセスによる木材組織の脆弱化とナノ解繊
◇参考文献:
遠藤貴士、シンセシオロジー、2(4) 、310-320 (2009). 「バイオ燃料を木材からナノテクで生産する」(外部リンク)
ナノセルロースの比表面積と酵素糖化性
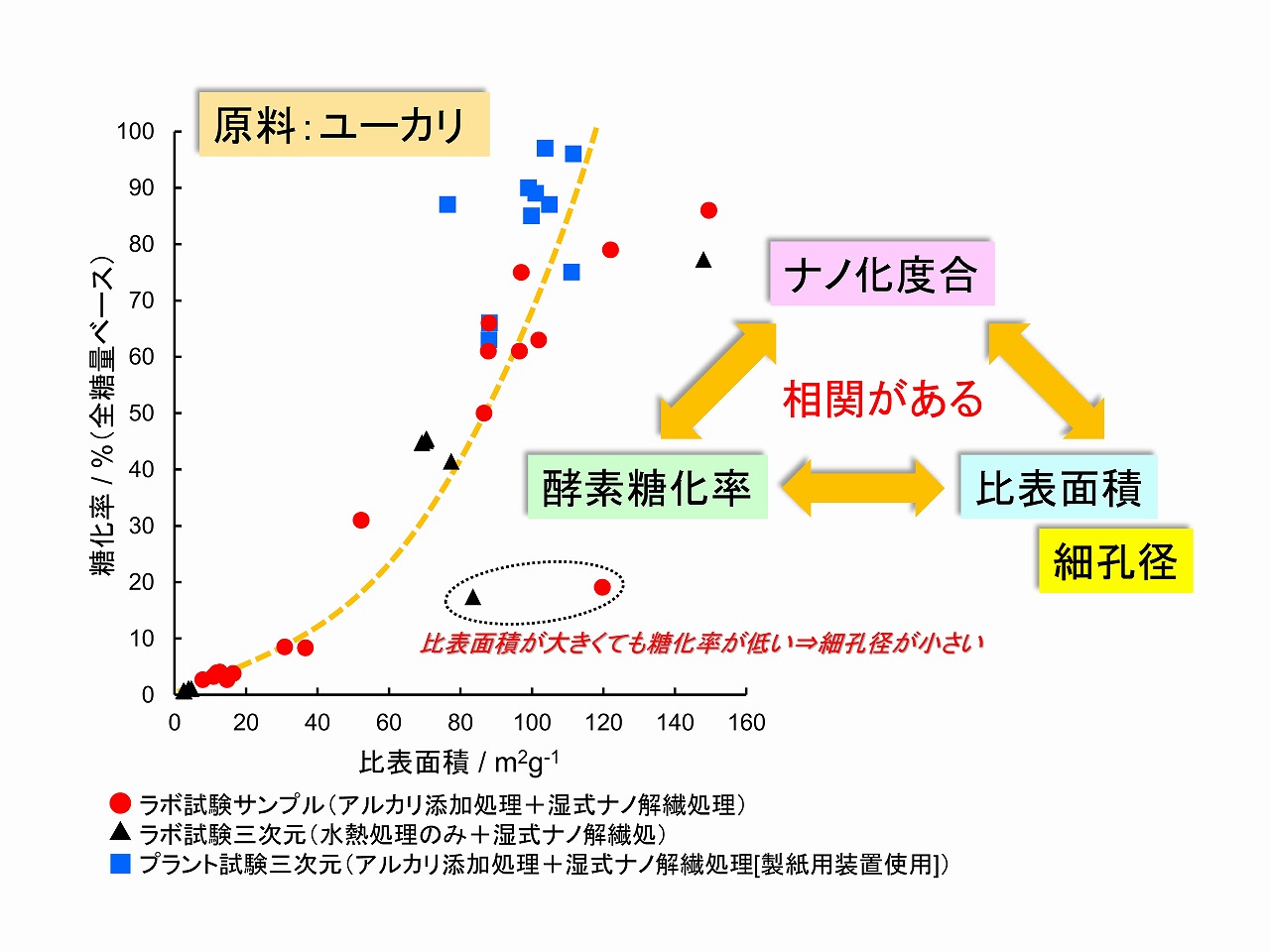
木材からのバイオエタノール製造では、酵素糖化の前処理として、ナノセルロース(セルロースナノファイバー/CNF)の製造が大切です。木材からナノセルロースを製造した場合のナノ解繊効率や製造したナノセルロースのほぐされ度合いを評価する方法として、比表面積測定はよく実施される方法です。そこで、種々の条件で前処理して製造したナノセルロースの酵素糖化性と比表面積の関係を下図に示しました。ここで用いた原料木材は、ユーカリです。この場合の前処理は、木材成分の大きな変質は起こらない条件で実施していますが、ヘミセルロースは若干、加水分解し、リグニンも一部分解しています。前項で示したように、ヘミセルロースの部分的加水分解は、木材の直接的なナノ解繊(ナノセルロース製造)では重要ですが、リグニンの除去は、特には重量ではありません。
比表面積が大きくなると、酵素糖化率も向上しています。つまり、原料のナノ化度合い、比表面積、酵素糖化率の間には、高い相関性があることが分かります。同じ原料で、同系列の前処理を実施した場合、比表面積から酵素糖化性を評価することができます。酵素糖化では、比表面積以外の要因も影響することがあるため、原料やプロセスが異なる系で、単純に比表面積から酵素糖化率を単純比較することが難しい場合はあります。
酵素糖化では、比表面積以外にさらにポイントがあります。前図では、比表面積と酵素糖化性の間に高い相関性があることを説明しいますが、下の方に破線円で囲った部分は、比表面積が大きいにも関わらず、酵素糖化率は高くありません。しかし、このサンプルを少し高いせん断が印加できるボールミルを用いて湿式解繊処理をすると、比表面積はわずかに大きくなりましたのみでしたが、酵素糖化率は、80%以上になりました。この変化は、比表面積測定と同時に実施した、細孔径の測定から、理由を解明することができまた。 比表面積が大きいにもかかわらず、酵素糖化率が低いサンプルは、細孔径が10nm以下でした。湿式ボールミル処理を行った後では、細孔径は15nm程度になりました。前述のように、セルラーゼは酵素としては大きく、酵素が移動できる空間がセルロース(セルロースミクロフィブリル/ナノセルロース)の周囲にないと酵素糖化は進行しません。細孔径が大きくなることは、自由空間が広がっていることを意味しており、酵素糖化も進行したと考えられます。そのイメージを下図に示しました。
◇参考文献:
1. Maki Ishiguro, Takashi Endo, Bioresource Technology, 153, 322-326 (2014),
“Addition of alkali to the hydrothermal–mechanochemical treatment of Eucalyptus
enhances its enzymatic saccharification”.
2. Maki Ishiguro, Takashi Endo, Bioresource Technology, 177, 298-301 (2015),
“Effect of the addition of calcium hydroxide on the hydrothermal-mechanochemical
treatment of Eucalyptus”.
ナノセルロースの表面特性と酵素糖化性
ナノセルロース(セルロースナノファイバー/CNF)の酵素糖化特性の精密解析から、ナノセルロースの表面状態を明らかにすることができます。木材の主要成分は、セルロース、ヘミセルロース、およびリグニンですが、それら成分は、適当に混在しているのでは無く、セルロース表面(セルロースミクロフィブリル表面/ナノセルロース表面)に、決まった順番で積層しています。
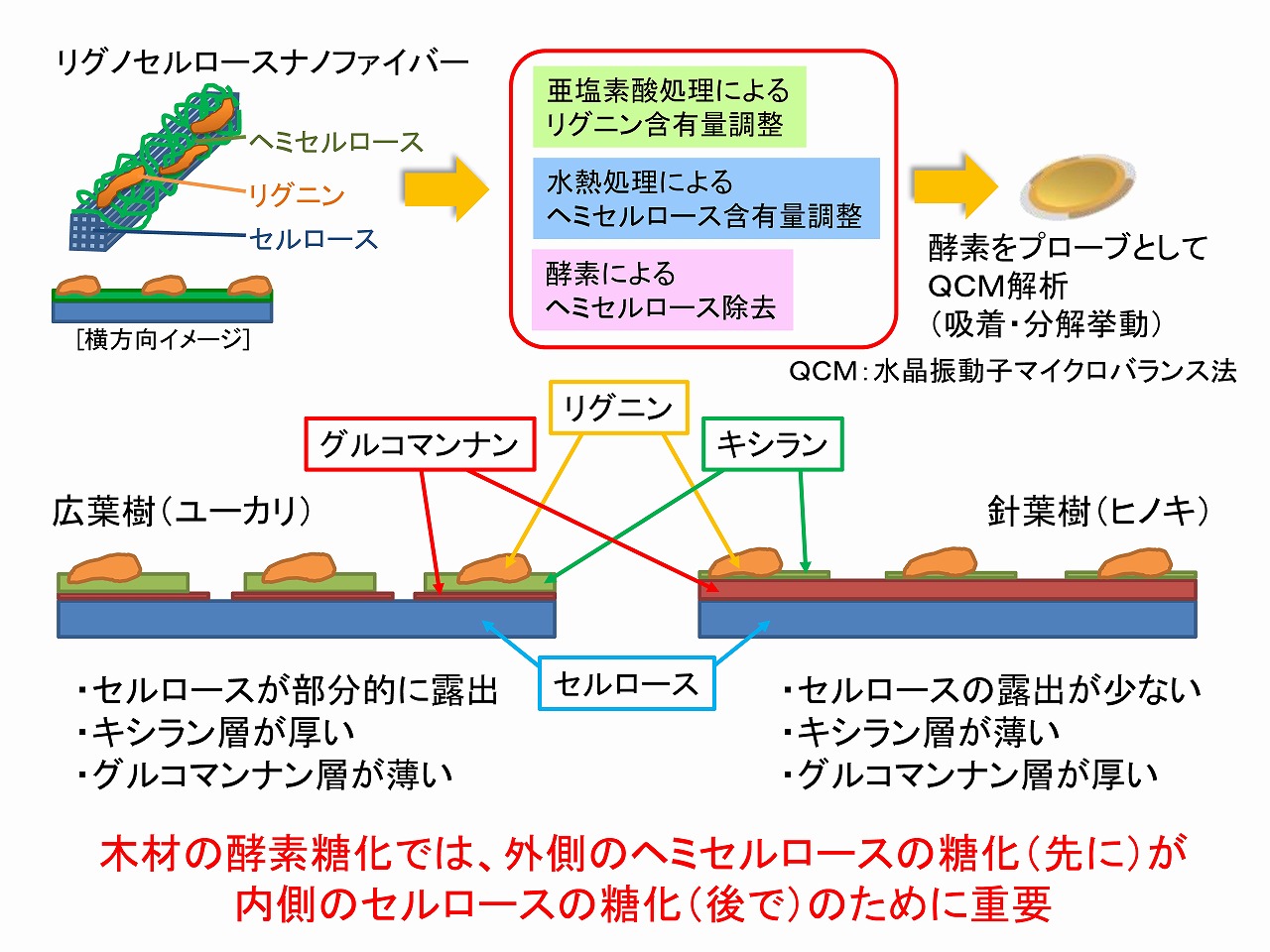
セルロースは、物質としては分子構造は1種類です。しかし、ヘミセルロースは、特定の物質を示しているわけでは無く、グループの名称です。ヘミセルロースには、キシラン、グルコマンナンなど、様々なものがあり、分子構造はバラついています。それらの積層状態は、木材の種類でも異なっています。下図に、木材(針葉樹、広葉樹)から直接的にナノ解繊のみで製造したナノセルロース(リグノセルロースナノファイバー)をサンプルとして、水晶振動子マイクロバランス法(QCM法)を用いて表面状態を精密解析して得られた結果です。ナノサイズの有機物サンプルの表面を、分光分析等で詳細に調べることは簡単ではありません。しかし、QCM法を用い、基質特異性のある酵素を用いて、ナノセルロースの表面から、酵素の吸着と分解特性を解析することで、積層構造を解析することができます。木材から直接的に製造したナノセルロースの表面状態や木質成分の積層構造は、基本的には未処理の木材とほぼ同一と考えられます。
下図に示すように、セルロースは最も深部にあります。ナノセルロースでは(木材サンプルは、ほぼ同様と考えられる)、最も外側にはリグニン、その次の層はヘミセルロース(キシラン/グルコマンナン)、最も深部がセルロースです。広葉樹では、セルロースが一部露出していますが、針葉樹パルプでは、セルロースはヘミセルロース等に覆われています。そのため、セルロースを酵素糖化するためには、外側のヘミセルロースを先に糖化する必要があります。前述のように、酵素糖化用の市販の工業用セルラーゼは、真の意味のセルラーゼ以外にヘミセルロースの種類や量が工夫されているようです。リグニンは、最も外側にあり、セルロース表面を広くカバーしていることも無く分散しており、古くからの研究からも、セルロースとリグニンの間には、共有結合はほぼ無いとされています。そのため、リグニンが酵素糖化を阻害することは、それほど考えられず、酵素糖化が進行すれば、リグニンは、自然と遊離してくると考えられます。
前述では、ナノセルロース(セルロースナノファイバー/CNF)における木材成分の積層構造から、リグニンは酵素糖化を阻害しないと記載しました。しかし、過酷な前処理を実施すると、リグニンが阻害物質に変化することがあります。下図には、水熱処理の温度と酵素糖化性から、リグニンの影響をQCM法で解析した結果を示しています。リグニン量が未調整のサンプル(原料木材と同様の成分組成)では、水熱処理温度が160℃を超えると、酵素は吸着するものの、酵素糖化はありまり進行しなくなります。一方、リグニン量を亜塩素酸処理で調整(減少させる)したサンプルでは、高温の水熱処理でも、酵素糖化性は低下していません。リグニン量未調整のサンプルにおいて、高温の200℃で水熱処理したサンプルでは、球状のリグニン変性物が生成して、セルロース表面を覆っています。水熱処理を実施しているため、ヘミセルロースは分解されています。つまり、変性リグニンは、セルロース表面をダイレクトに覆っており、セルラーゼを吸着されているものの、セルロースに接近しにくくなっているため、酵素糖化は進行しません。この変性リグニンは、一度溶解後に再凝固していると考えられ、表面張力から球状になっていると考えられます。球状のリグニンであることから、リグニンスフィア(Lignin
Sphere)とも呼ばれています。この変性リグニンは、洗い流すと酵素糖化が進行するようになります。下図では、140℃の処理での酵素糖化が高くありませんが、これは加水分解されずに残存しているヘミセルロースの影響、つまり、ヘミセルロースがセルロース表面を覆っているためセルロースへのセルラーゼの吸着量が少なく、酵素糖化が遅いと考えられます。セルラーゼがセルロースに吸着できるかどうかが、酵素糖化ではまず最初にとても重要です。
※QCM法の測定グラフでは、ナノセルロースがコートされた水晶振動子センサーの重量変化を示しています。グラフが上向きに変化しているところは、酵素が吸着し重量が増加したことを示しており、グラフが下向きに変化したところは、糖化により重量が減少していることを示しています。
以上のように、木材の酵素糖化では、従来から言われている、セルロースの結晶性やリグニンの阻害の影響などは、適切な前処理を行えば、基本的に無関係です。セルラーゼがいかにセルロースに接近して動けるかで酵素糖化性は決まると言えます。ナノセルロースは、素材・材料としても高いポテンシャルを持っていますが、材料に使えない低品質のナノセルロースは、糖化してバイオエタノール等に変化することも意味があると考えられる。これらのことから、ナノセルロースを軸とすると、木材資源のマテリアルおよびエネルギーの併産システムも構築可能と考えられます。
◇参考文献:
1. Akio Kumagai, Seung-Hwan Lee, Takashi Endo, Biomacromolecules, 14(7), 2420-2426 (2013). “Thin Film of Lignocellulosic Nanofibrils with Different Chemical Composition for QCM-D Study”.
2. Akio Kumagai, Seung-Hwan Lee, Takashi Endo, Biotechnology and Bioengineering, 113(7), 1441- 1447 (2016), “Evaluation of the effect of hot-compressed water treatment on enzymatic hydrolysis of lignocellulosic nanofibrils with different lignin content using a quartz crystal microbalance”.
3. Akio Kumagai, Takashi Endo, Cellulose, 25(7), 3885- 3897 (2018), “Comparison of the surface constitutions of hemicelluloses on lignocellulosic nanofibers prepared from softwood and hardwood”.
◇参考ページ:
1. 「研究紹介」-「水晶振動子マイクロバランス法によるナノセルロース表面特性解析技術」
2. 「連携可能な技術のご紹介」-「水溶液中の物質の吸脱着をリアルタイム評価」
リグニンと酵素(セルラーゼ)
前述のように、分子が糖で構成されているセルロースやヘミセルロースと異なり、芳香族系化合物のリグニンは、酵素糖化系に共存していても、前処理を適切に行えば、酵素糖化は進行します。木材等からのバイオエタノール製造では、最初のステップとして、酵素糖化の効率化が大切です。これまでに示したような様々な前処理を施した木材サンプルの酵素糖化試験から、高温の水熱処理等の影響を受けていない(変質していない)通常のリグニンは酵素糖化の阻害物質ではないことを示してきました。しかし、前述のように高温の水熱処理のよう強い条件で前処理することで生成した変性リグニンは、酵素を吸着して糖化を阻害します。
前処理における木材成分の変性は、酸性条件下でより顕著に発生します。高温高圧の熱水は、水素イオン濃度が上昇し、硫酸処理と同様の反応が起きます。木材を水熱処理した場合、ヘミセルロースが加水分解すると、ヘミセルロースの側鎖等が加水分解して、酢酸が生成して、酸性になります。酸性かつ高温の条件では、木材成分の変性が起きやすくなります。そのため、アルカリを添加した状態で水熱処理を行うと、ヘミセルロースの加水分解で発生した酢酸を中和し、変性が置きにくくなります。リグニンについても、酸性条件下よりは、中性・弱アルカリ性の方が、高温での変性は少なくなると考えられます。
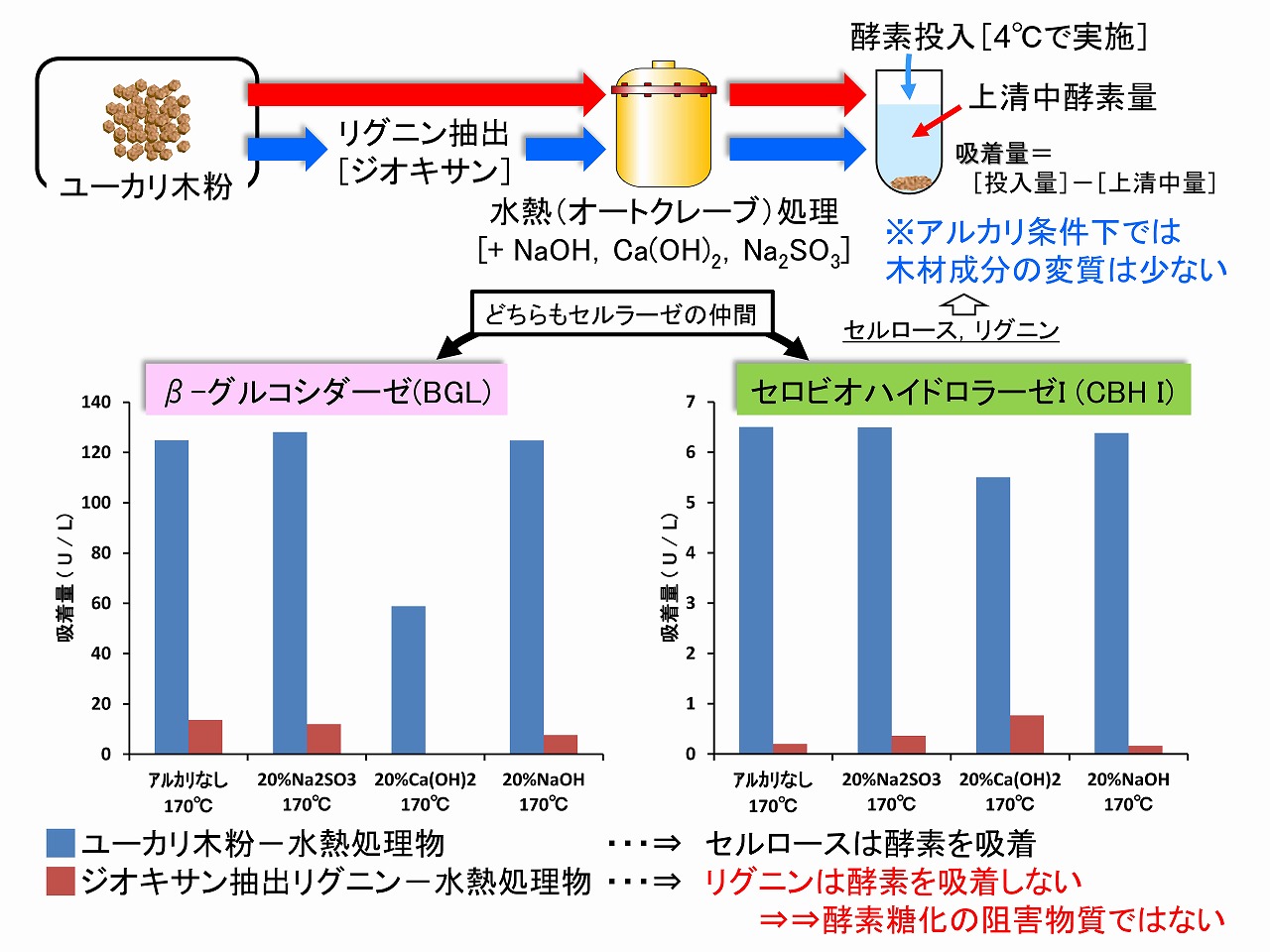
以上のような、アルカリ添加条件での水熱処理(オートクレーブ処理)は、木材成分の変性をある程度抑制して、その特性を評価するのに役立ちます。ただ、未処理の木材(生木)と同等の特性や化学構造を維持しているかどうかは分かりません(評価・解析では、多くの場合、抽出や精製工程が必要なため、完全未処理の木材成分を解析する方法がないため)。
以上のような前提のもと、原料木材(ユーカリ)を、水のみ、あるいはアルカリを添加して水熱処理し、また、あらかじめジオキサンで抽出(木材化学の標準的方法)しておいたリグニン成分も同様に水熱処理し、その処理物の酵素吸着特性を調べました。下図にその結果を示しています。これらの試験は、4℃で行っているため、セルラーゼによる加水分解はほとんど進行していません。酵素の反応至適温度の50℃にすると、80~100%近くグルコースに糖化されます。セルラーゼの仲間である、セロビオハイドロラーゼやβ-グルコシダーゼ用いて評価したところ、水熱処理した木材サンプルは、これら酵素を吸着していることが分かります。主に、セルロースに吸着していると考えられます。一方、抽出しておいたリグニン成分の水熱処理物は、セロビオハイドロラーゼやβ-グルコシダーゼの吸着量は少ない結果でした。これらのことは、変性していない(少ない)リグニンは、セルラーゼを吸着しない、つまり、酵素糖化の阻害物質ではないことを示していると考えられます。
以上のように、木材の酵素糖化においては、過酷な前処理を行わなければ、基本的に、セルロースの結晶性は酵素糖化には無関係、リグニンは酵素糖化の阻害物質ではないと言えます。
◇参考文献:
1. Maki Ishiguro, Takashi Endo, Bioresource Technology, 153, 322-326 (2014), “Addition of alkali to the hydrothermal–mechanochemical treatment of Eucalyptus enhances its enzymatic saccharification”.
2. Maki Ishiguro, Takashi Endo, Bioresource Technology, 177, 298-301 (2015), “Effect of the addition of calcium hydroxide on the hydrothermal-mechanochemical treatment of Eucalyptus”.
木材を糖化して得られる糖類
バイオエタノール製造のための木材の糖化では、セルロースとヘミセルロースが加水分解され、分子を構成している糖に変換されます。セルロースからは基本的に炭素数6個のグルコース(ブドウ糖)が得られます。セルロース分子は、グルコースのみが鎖状につながった分子です。一方、ヘミセルロースからは、様々な糖(グルコース、マンノース、ガラクトース、キシロース、アラビノース等)が生成します。ヘミセルロースは、特定の化合物を指している用語ではなく、グループの名称です。ヘミセルロースには、キシランやグルコマンナンなど様々なものがあります。これらキシラン等も分子構造は単一ではなく、枝分かれがあったり、側鎖があったりします。キシラン分子の主分子鎖は、炭素数5個のキシロースから構成されています。
炭素数6個のグルコース、マンノース、ガラクトースは、一般的な酵母菌でエタノールへ変換できますが、炭素数5個のキシロースやアラビノースは代謝されず、簡単には変換できません。そのため、酵母菌の遺伝子操作や新規な菌の探索などが重要になつています。木材は、大きく分けると広葉樹と針葉樹ですが、木材種の違いでヘミセルロースの構造は異なり(リグニンも構造が異なります)、糖化で得られる糖組成も異なります。
下図に、セルロースやヘミセルロースを加水分解して得られると糖類と樹種による糖組成の違いを示しました。成分組成・糖組成は、樹種(ヒノキ、スギ、シラカバ、ユーカリ、トドマツなど学名に基づく種)や産地、気候等で変化するため、組成はあくまで平均的な参考値です。
酵素糖化にリグニンやセルロース結晶性は影響しない!(実験結果)
前述のように、木材からのバイオエタノール製造で最初のステップとなる酵素糖化では、共存するリグニンやセルロースの結晶性は基本的に影響しないこと、セルラーゼ等のセルロースへのアクセシビリティ、つまり比表面積が重要であることを解説しています。ここでは、基礎的な実験事例でさらにそれらの根拠を説明します。
木材の主要成分中、セルロースやヘミセルロースは分子が糖で構成された多糖類ですが、リグニンは全く構造が異なる芳香族化合物です。そのため、リグニンが酵素糖化を阻害するという意見も多くあります。前述のように、ヘミセルロースやリグニンは、セルロース(ミクロフィブリル/ナノセルロース)の表面に積層しています。リグニンは、セルロースミクロフィブリルの表面を完全に覆っていることはありません。しかし、酵素糖化において構造の異なるリグニンの存在は、気になるところです。
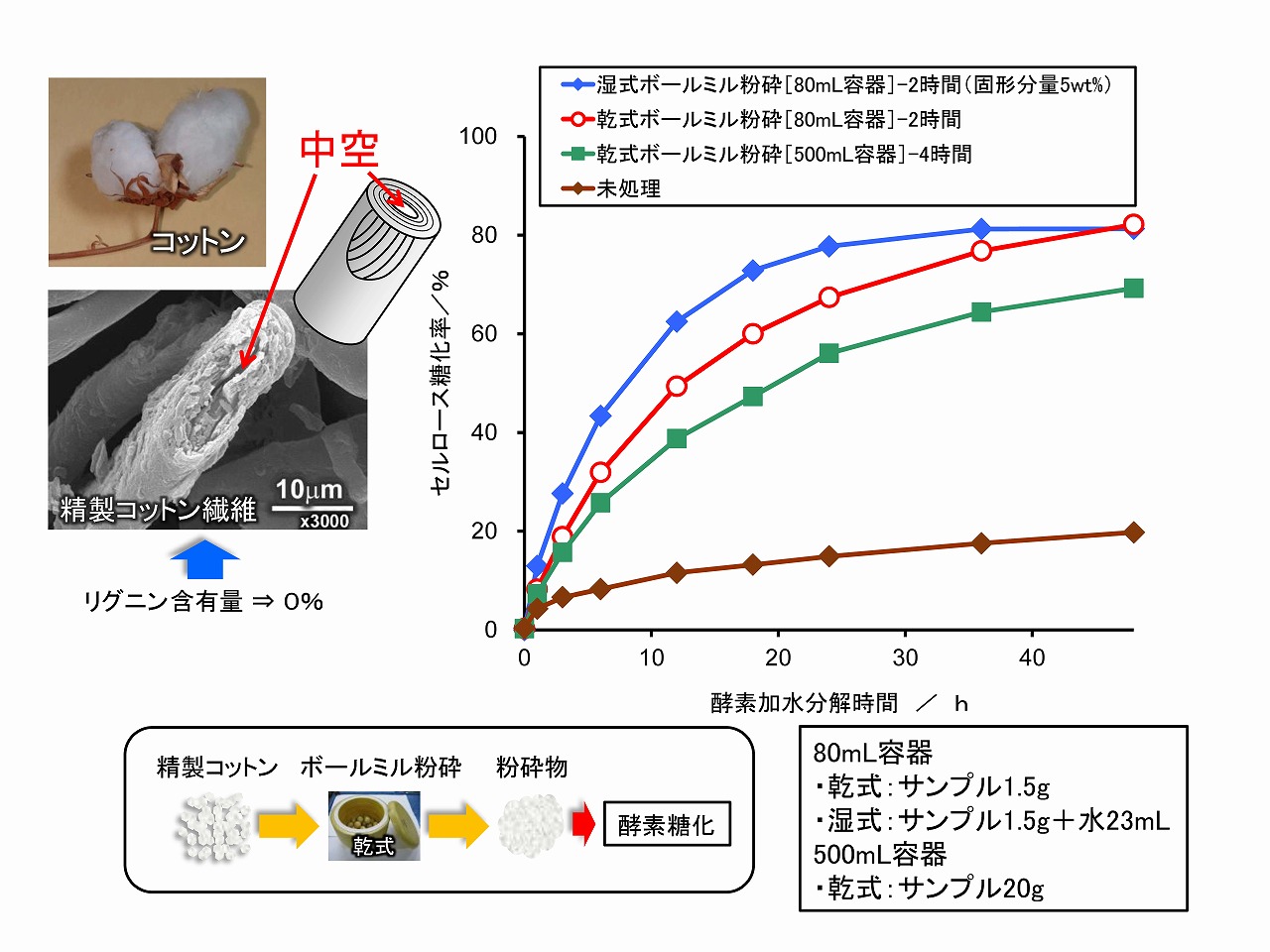
それではリグニンを含まないセルロース原料は、簡単に酵素糖化できるのでしょうか?その点を検証した実験結果を下図に示しました。酵素糖化のためのサンプルとしては、コットン原料(リンター)を酸加水分解等で精製してあるカラム担体としても用いられているリグニンを含んでいないサンプル(ワットマン社、CF11)を用いました。精製物であってもコットン繊維独自の緻密な組織構造は残っています。
酵素糖化は、原料を未処理でそのまま酵素糖化試験、および乾式ボールミル粉砕処理(セルロースの非晶質化/セルロース結晶を低下)、湿式ボールミル粉砕処理(ナノセルロース化/セルロースの結晶性維持)による前処理サンプルの酵素糖化試験を実施しました。その結果、リグニンを含まない精製コットン繊維では、未処理サンプルの酵素糖化性は低い結果であったが、乾式ボールミル粉砕処理により酵素糖化性は向上し、湿式ボールミル粉砕処理では、さらに酵素糖化性が向上する事が示されました。この結果は、リグニンの有無は酵素糖化には影響せず、組織構造(セルラーゼ等のアクセシビリティ)が酵素糖化に影響していることを示しています。
精製コットン繊維の酵素糖化では、前処理としてボールミル粉砕処理を実施しています。このような機械的処理では、印加された圧力やせん断力によりセルロースミクロフィブリルはタメージを大なり小なり受けます。そのため、セルロースの結晶性は低下する方向に行きます。
木材系原料を乾式ボールミル粉砕すると酵素糖化性が向上することは古くから知られています。乾式ボールミル粉砕では、セルロースの結晶性は大きく低下します。そのため、セルロースの結晶性を低下させることが酵素糖化を促進するために重要と言われてきました。実際、我々の研究グループにおいても、広葉樹としてユーカリ、針葉樹としてベイマツ、比較として精製パルプを乾式ボールミル粉砕処理し、精製物のセルロース結晶性と酵素糖化性の関係を評価しました。下図にその結果を示しました。
その結果、ユーカリ、ベイマツでは、乾式ボールミル粉砕時間が長くなるのに従って、セルロースの結晶性は低下し、反対に酵素糖化性は向上しました。しかし、セルロースの結晶性は粉砕と共に急激に低下しましたが、酵素糖化性は、ゆっくりと向上しました。また、精製パルプでは、セルロース結晶性が高くても酵素糖化は進行し、乾式ボールミル粉砕によりセルロース結晶性は低下しましたが、酵素糖化性との相関は高くありませんでした。
これらの結果は、セルロースの結晶性と酵素糖化性は、相関があるように見えますが、相関性は必ずしも高くないことを示しています。
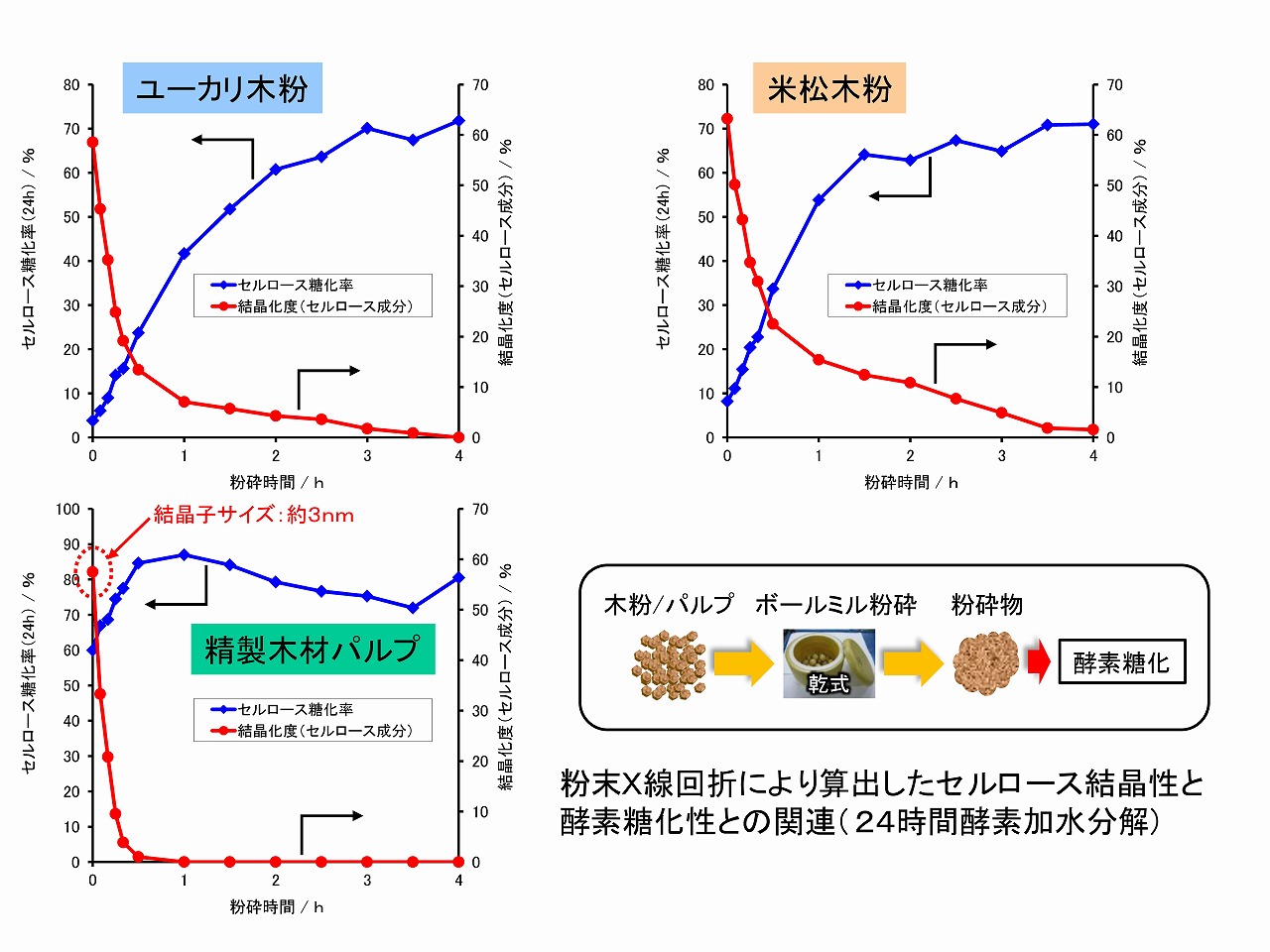
セルロース結晶性と酵素糖化性
木材系原料の乾式ボールミル粉砕と湿式ボールミル粉砕では、精製物のセルロース結晶性は大きく異なります。下図にユーカリ木粉を原料として、未処理の木粉、乾式ボールミル粉砕物、湿式ボールミル粉砕物のエックス線回折パターンとセルロース結晶化度、および、それらの酵素糖化性を示しました。未処理のユーカリ木粉の酵素糖化性は、低い値しか示しません。しかし、乾式ボールミル粉砕処理では、セルロース結晶性は、ほぼゼロ、つまり非晶質(アモルファス)になっています。この非晶質サンプルは、高い酵素糖化性を示しました。一方、湿式ボールミル粉砕物は未処理の原料木粉と同程度のエックス線回折パターンと結晶化度を示しましたが、酵素糖化性は非晶質サンプルと比較して、若干低いものの、高い値を示しました。
これらの結果からも、未処理木粉と同程度の高いセルロース結晶性を持っていても、酵素糖化は進行することが示されています。つまり、セルロース結晶性の酵素糖化性への影響は少ないと言えます。
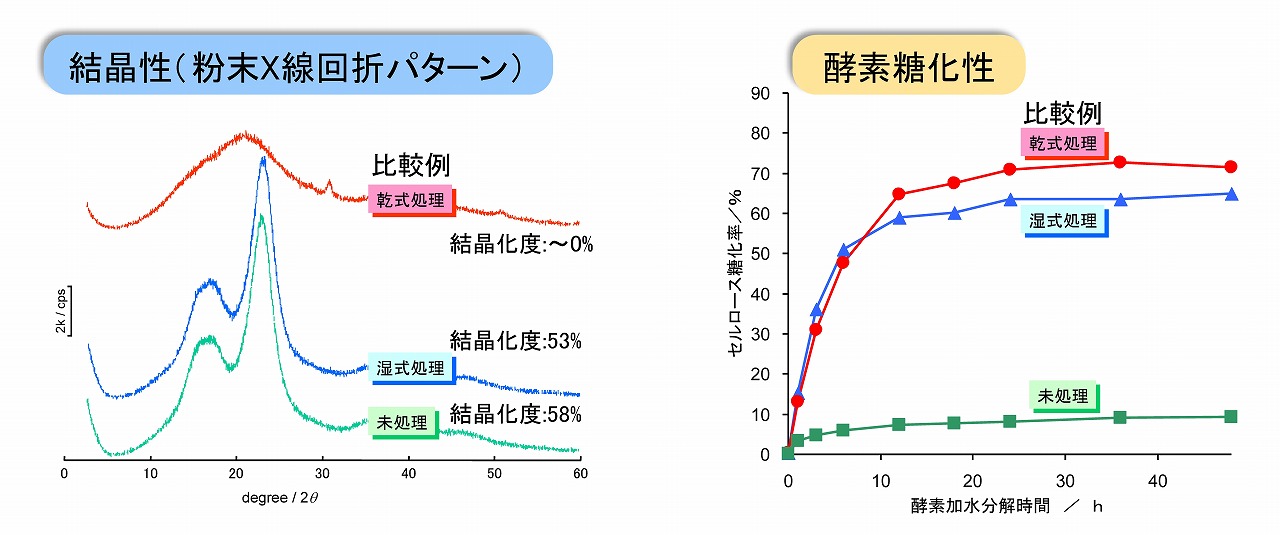
高結晶性セルロースサンプルの酵素糖化性
本ページでは、これまでに比表面積が酵素糖化性に大きく影響することを示してきました。大きな表面積を持つセルロース系原料では、セルラーゼ等の酵素のアクセシビリティが向上して、酵素糖化も進行します。しかし、原料を乾式ボールミル粉砕したサンプルでは、比表面積と酵素糖化性に相関が薄いという報告もあります。前述のように、乾式ボールミル粉砕では、セルロース結晶性は低下するため、結晶性が支配的因子と解釈されている場合もあります。
そこで、未処理では酵素糖化性が低い広葉樹としてユーカリを乾式ボールミル粉砕し、比表面積と酵素糖化性の関係を検証しました。比表面積測定は、乾式ボールミル粉砕で得られた生成物を、そのまま直接に酵素糖化試験を実施するとともに、ガス吸着によるBET法で比表面積測定して得られた結果と、乾式ボールミル粉砕物を、一度、1日程度、水に浸漬して、次いで、t-ブタノールを用いたアルコール置換後に、凍結乾燥して得られた粉砕物の酵素糖化試験を行い比較を行いました)。
その結果を下図に示しました。乾式ボールミル粉砕物を直接に酵素糖化した場合、アルコール置換・凍結乾燥後の処理物、このどちらも酵素糖化は進行しました。糖化率は、アルコール置換・凍結乾燥後の生成物の方が高い傾向を示しました。
しかし、これらサンプルの比表面積測定結果は、大きく異なるものでした。乾式ボールミル粉砕物をそのまま直接的に測定して得られた比表面積は、酵素糖化性とは低い相関性しか示しませんでした。一方、同じ乾式ボールミル粉砕物でも、アルコール置換・凍結乾燥後の処理物では、比表面積と酵素糖化性は高い相関を示しました(下図)。
この結果は、酵素糖化が水中で行われることを考えれば、理解することができます。水中での状態を考慮せずに測定した比表面積の値は、酵素糖化と関係づけて考えることはできないと言えます。
乾式ボールミル粉砕物は、そのまま直接的に測定すると比表面積は小さい値しか示しませんが、一度、水に浸漬し、その状態を保持したまま乾燥処理を行った処理物では、乾式ボールミル粉砕時間に応じて、比表面積は大きくなっています。つまり、乾式ボールミル粉砕物は、酵素糖化を行う水中では、大きな比表面積を持ち、セルラーゼ等の酵素のアクセシビリティが向上して酵素糖化が進行することを示しています。
以上のように、木材系原料の酵素糖化では、比表面積で示されるセルラーゼ等の酵素のセルロースへのアクセシビリティが極めて重要であることが分かります。
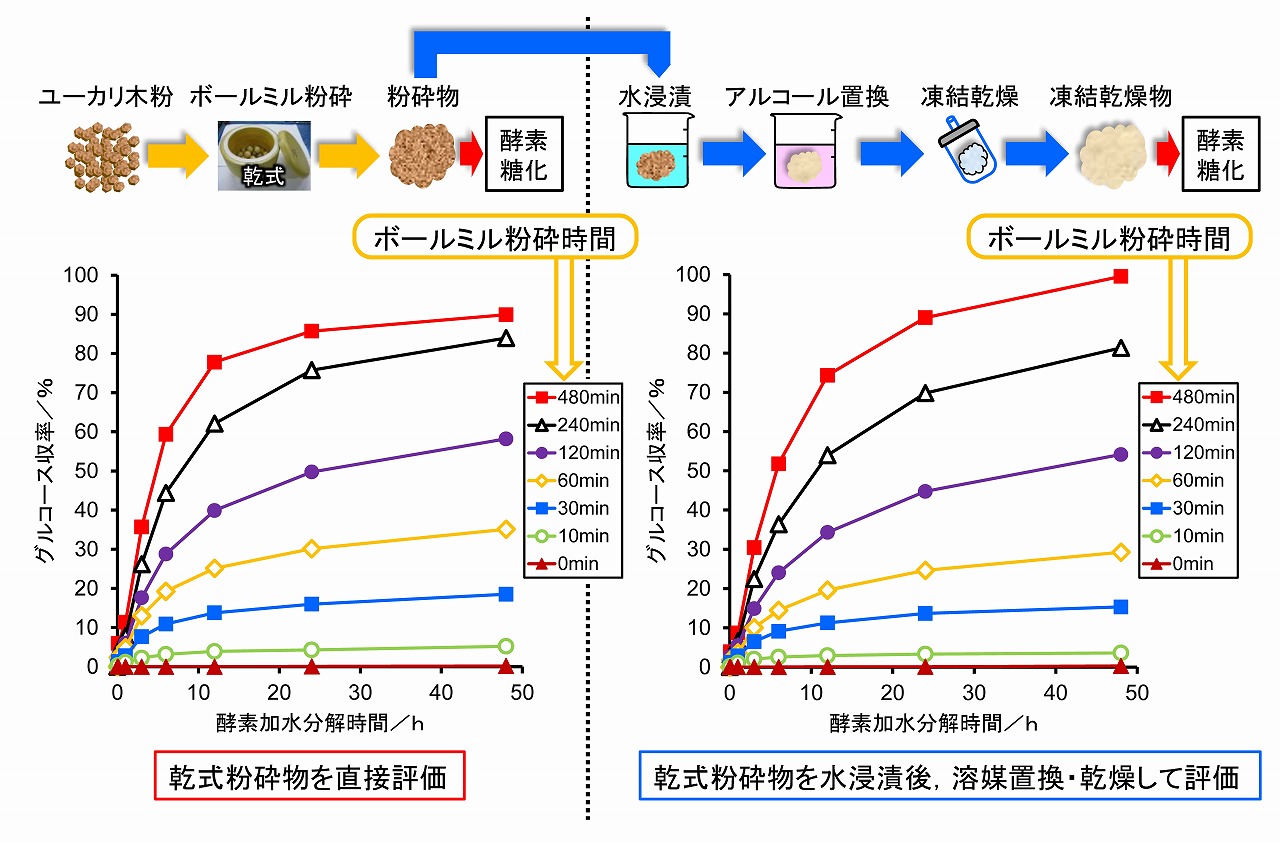
乾式ボールミル粉砕物の酵素糖化性
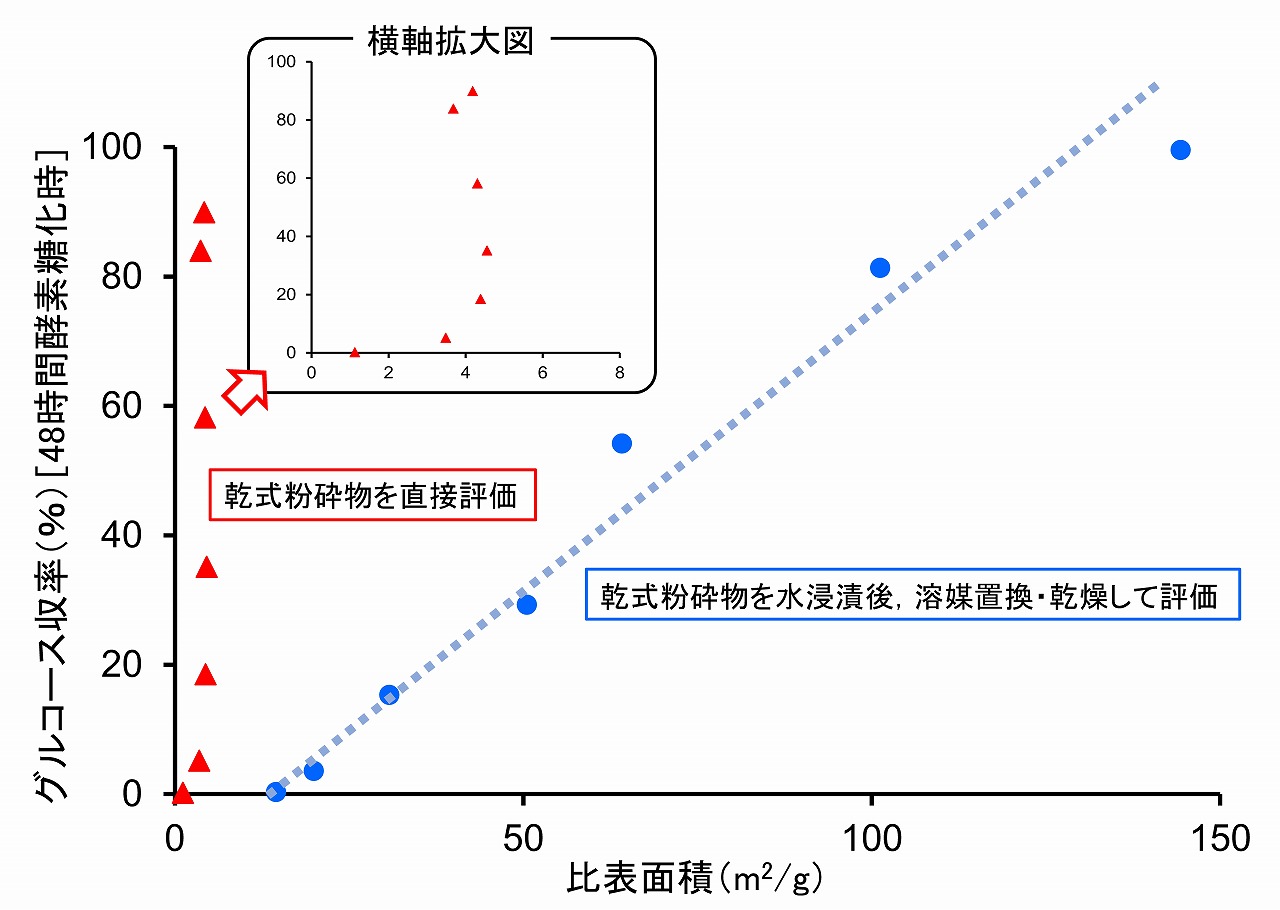
乾式ボールミル粉砕物の比表面積測定結果
◇参考ページ:
1. 「技術のポイント」-「エックス線回折法によるナノセルロースの結晶性評価」
2. 「技術のポイント」-「比表面積測定によるナノセルロースの評価」
3. 「技術のポイント」-「簡単な?ナノセルロースの作り方。」
追記事項
セルロース材料グループ