研究内容紹介
革新的なイメージング技術による細胞/組織の解析
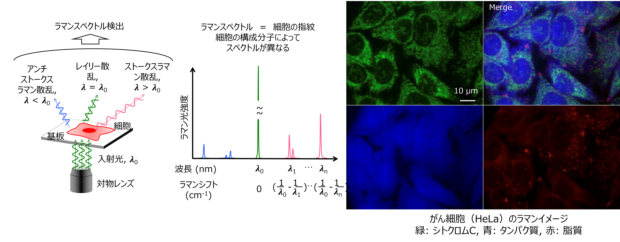 |
大阪大学・井上研究室、藤田克昌研究室との共同研究を行っています(上記図は、藤田克昌先生ご提供)。
試料中の分子の振動を検出して画像化するラマン散乱顕微鏡を用いた細胞組織内分子の可視化の研究を行っています。
分子の振動は化学結合の種類を示すため、分子の構造や状態を分析しながらその分布を観察できます。
タンパク質や核酸などを含む様々な生体内分子を、高感度で、細胞に悪影響を与えず、経時的に測定できる事から
細胞組織チップ、複合組織チップ、MPS(微細生理システム)上の細胞組織の解析に役立つ技術です。
動物実験を代替する複合組織チップ・MPS(微細生理システム)デバイスの構築を目指して
創薬・化粧品・食品添加物・農薬などの毒性・薬効評価において、細胞レベルの毒性・機能評価に加えて、
ADME(吸収、分布、代謝、排泄)を中心とした全身性評価が必要不可欠です。よって、従来はヒト臨床研究
に先立ち、動物実験によりADME評価を担保してきました。しかし、EUでは2013年に化粧品開発における動
物実験が全面禁止され、動物愛護の観点などから、可能な限り動物実験を行わない事が世界的な潮流となってい
ます。そこで、動物を用いたADME評価を代替するオンチップ実験系の構築が期待されています。
そこで我々は、細胞分子工学研究部門の金森・杉浦らの開発した35mmディッシュサイズの2臓器連結型還流培養チャンバーを
用いて、様々な人工臓器モデルの長期間の時系列観察を実施しています。
2か所のチャンバーは、マイクロ流路で結ばれており、特許技術に基づいた圧力駆動還流培養技術により、血流循環を模した還流培
養を行う事が可能です。時系列細胞モルフォロジー解析による薬効評価系の構築、及び人工ADMEモデル作製を目指した研究
開発を進めています。
リバーストランスフェクション技術を応用したTCMチップ
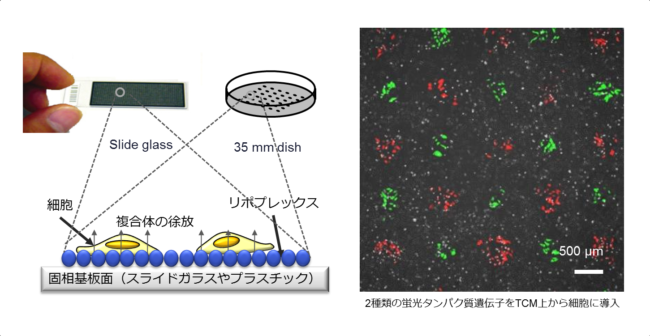 |
リバーストランスフェクション(Reverse Transfection: RTF)技術とは、基盤などの界面(固相面)から細胞に遺伝子などの核酸(DNAやRNA)を導入する手法です。
核酸とカチオン性リボソームやカチオン性高分子との複合体(Lipoplex、Polyplex)をベースとした溶液を作製し、スライドガラスやポリスチレン、シリコン、金属基盤などの固相面に固相化し、続いて細胞を播種する事によって、固相界面から細胞に遺伝子を導入することができます。
我々のグループでは、本RTF法を応用し、チップ基盤などに遺伝子をアレイ状に配置、集積化したトランスフェクションマイクロアレイ(Transfected Cell Microrray: TCM)の開発を進めています(参考文献1、2)。
様々な遺伝子やsiRNAをアレイ状に配置したチップを作成し、細胞を播種する事で、アレイ状に配置されたそれぞれのスポット上の細胞に異なる遺伝子を導入することが可能です。
これまでの多くの場合、遺伝子のハイスループットスクリーニング(HTS)や機能評価において、遺伝子の拡散や細胞の移動を防ぐため、マルチウェルプレートなどを用いた評価が行われて来ました。
しかし本技術を用いた「TCMチップ」を作製することで、DNA チップ等と同じように多検体を高密度化して大規模かつ高速な細胞の表現型に基づいた遺伝子や細胞の機能解析や薬剤評価をおこなう事が可能となります。
これによって、細胞培養に必要な培地、試薬が従来に比べて少量ですむため、細胞培養用マルチウェルを用いた従来の実験法に比べて、1実験当たりのコストが大幅に減少します。
さらに、実験単位当たりに必要な細胞の数も少しで済むため、貴重な細胞種(初代培養細胞や幹細胞など)を用いた研究に威力を発揮します。
現在、低分子化合物やタンパク質のCell Microarray(細胞マイクロアレイ)の開発も進めています。
参考資料:
1) Yamada, S. et al., (2009) Biosens. Bioelectron., 96, 1493-1497
2) Yamada, S. et al., (2008) Neuroreport, 19, 1733-1738
3) Fujita, S. et al., (2007) J. Biosci. Bioeng., 96, 329-333
4) Yamada, S. et al., (2007) Biochem. Biophys. Res. Commun., 363, 926-930
5) Yamada, S. et al., (2007) Neuroreport, 18, 359-363
6) Yoshikawa, T. et al., (2004) J. Control Release, 96, 227-232
7) 薬剤が細胞に与える影響を評価するシステム(2014年4月4日)特許登録:第5510783号
一細胞TCMチップ
動物組織や細胞集団中の1細胞毎の振舞いを制御し品質管理をする上で、1細胞解析技術に加えて、1細胞毎にシグナルを導入し、その振舞いを制御する技術開発が重要です。
即ち、1細胞毎に異なる遺伝子、タンパク質、化学物質を導入する技術開発により、組織や細胞集団の厳密な制御が可能になると期待されます。
我々は、ポリエチレングリコール(PEG)誘導体をガラス基板にグラフトし細胞の非接着領域を構築した後、
細胞外マトリックス(ECM)溶液をその上面にスポットする事で細胞の接着領域のマイクロパターンの作製できる事を見出しました。
ピエゾ素子を用いたインクジェットプリントにより、50 マイクロメートル径の細胞接着領域に1細胞を隔離し、さらにその領域から核酸遺伝子を導入する事に成功しました。
これにより、1細胞毎に異なる遺伝子の導入を可能とする細胞用マイクロアレイチップの構築が可能となりました。
参考資料:
1) 細胞解析法が進歩してきた今こそ一細胞遺伝子導入法の開発が必要(2015年10月30日)
日経バイオテクOn Line
2) Fujita, S. et al., (2013) Lab Chip, 13, 77-80
3) 細胞接着領域のマイクロパターンを有する細胞固定化基板の製造方法(2012年10月4日)
特開2012-187072
4) Hakamada, K. et al., (2010) J. Biosci. Bioeng., 109, 62-66
細胞運動を評価する細胞マイクロアレイチップ
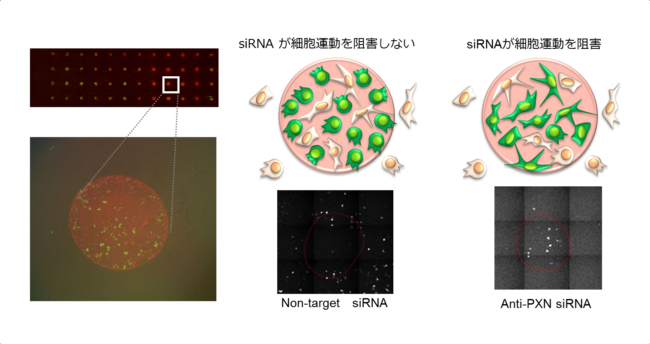 |
様々な生物学的現象を支える細胞運動には、大きく分けて各細胞がばらばらに移動する「単細胞遊走」と、複数の細胞が接着した状態でグループとして移動する「集団的遊走」の2種の運動様式が知られています。
癌転移においてもこの細胞運動は必須です。
集団遊走する癌細胞は局所転移やリンパ浸潤を起こしやすく、単細胞遊走する細胞は血行性の遠隔転移に関与すると考えられています。
そのため、単細胞遊走に焦点をおいた評価系の構築が非常に重要です。
そこで、我々は細胞運動の中でも単細胞遊走を評価する細胞マイクロチップの開発に着手し、世界で初めてその開発に成功しました。
また、この細胞マイクロアレイチップを用いて738種類のキナーゼ遺伝子のスクリーングを行い、細胞運動に関連する遺伝子群の絞込を行っています。
参考資料:
1) Onuki-Nagasaki, R. et al., (2015) BMC Genet., 16:9
2) Enomoto, J. et al., (2014) Sens. Actuators B Chem., 190, 896-899
3) がん転移の仕組み研究関係遺伝子を効率探索, (2014年11月13日)日経産業新聞社
4) 細胞運動性評価セルチップ(2012年6月29日)特許登録:第5024823号
5) Onuki-Nagasaki, R. et al., (2008) Lab Chip, 8, 1502-1506
一細胞に物質を送り込むDDS用マイクロマシン技術
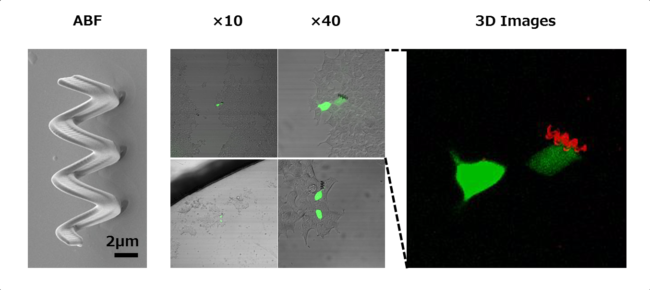 |
マルチフォトンリソグラフィー(DLW)による直接描画により紫外線硬化性エポキシ樹脂を硬化させる事で微小な人工鞭毛構造(Artificial Bacterial Flagella:ABF)のマイクロマシンを作製する事ができます。
さらにマイクロマシンをニッケルチタン等でコーティングすることでヘルムホルツコイルによる磁力で操作する事が可能となります。
我々はチューリッヒ工科大学のネルソン教授と共同で低分子を内包したリポソームや核酸を内包したリポプレックスを、このマイクロマシン上に固相化しました。
マイクロマシンを磁力でコントロールし、In vitro実験において目的の細胞にマイクロマシンを到達させ、1細胞のみに遺伝子を導入する事に成功しました。
参考資料:
1) Qiu, F. et al., (2015) Adv. Funct. Mater., 25, 1666-1671
2) Qiu, F. et al., (2015) Sens. Actuators B Chem., 196, 676-681
3) 遺伝子微小機械で運搬, (2015年1月28日)日経産業新聞社
