Sub-THz波照射によるタンパク質への非熱的作用
タンパク質が機能するには周囲の水が不可欠である。しかし、水が、どのような仕組みで、どの程度の時間・空間スケールで、タンパク質の機能に影響しているのかは分かっておらず、幅広いバイオ・医療応用への障害となっている。徳永 裕二a、田中真人b、飯田仁志c、木下基c、東島侑矢c、竹内恒a、今清水正彦a(a細胞分子工学研究部門、b分析計測標準研究部門 、c物理計測標準研究部門 )による共同研究グループは、サブテラヘルツ(sub-THz)波照射によってタンパク質と周囲の水の相互作用を励起し、その作用を原子レベルで観測する方法を開発した。本手法により、熱とは異なるタンパク質への励起作用が確認されたことから、水溶液中のタンパク質機能を制御するための有効なツールになることが期待される。
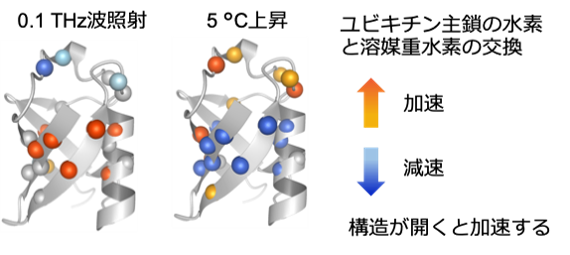
図1:sub-THz波照射と5 ℃の温度上昇が、水溶液中のユビキチンタンパク質に異なるダイナミクス変化を起こすことを溶液NMR観測により明らかにした。ユビキチン構造において、重水素交換の加速(オレンジ色)と減速(青色)が観測されたアミノ酸残基を丸で表示している。
■ 研究の社会的背景 ■
タンパク質を活用する生物による物質生産(スマートセルインダストリー)が注目を集めている。タンパク質機能のポテンシャルを最大限まで引き出すことにより、この取り組みをさらに発展させることができる。そのためには、タンパク質が水溶液中で働く仕組みを物理化学的に理解すること(=生物機能の「取扱い説明書」の整備)が必要である。その大きな障害となっているのは、タンパク質と水との相互作用の理解が不十分なことである。当り前の存在に思える水には特異な物性があり、水溶液中のタンパク質の機能にも大きな影響を与えるが、その詳細はわかっていない。そのため、抗体などのバイオ医薬や新型コロナで話題になったPCR反応など、タンパク質の機能を積極的に利用する様々な場面において、タンパク質と水の相互作用の詳細を調べることが、残された課題となっている。
■ 研究の経緯 ■
タンパク質の表面は複雑な形状や電荷の分布を持つため、タンパク質を取り囲む水は特徴的な水素結合のネットワークを形成し、空間的・時間的に不均質な運動を行う。このような不均質な運動が、タンパク質機能を理解する鍵を握っていると考えられる。しかし、従来、タンパク質との水素結合の影響を強く受ける水と、影響を受けないで自由に動く水を分けて解析することが難しく、十分な解析がなされていなかった。
これまでの研究により、この不均質な運動成分のうち、室温でタンパク質と結合した水の速い運動成分がsub-THz帯の周波数で観測されている。このため、産総研の共同研究グループでは、sub-THz帯の電磁波を用いてタンパク質と水の相互作用を直接かつ選択的に励起し、その際のタンパク質の変化をNMR法により原子レベルでとらえることで、この問題を解決する技術開発に取り組んできた。
■ 研究の内容 ■
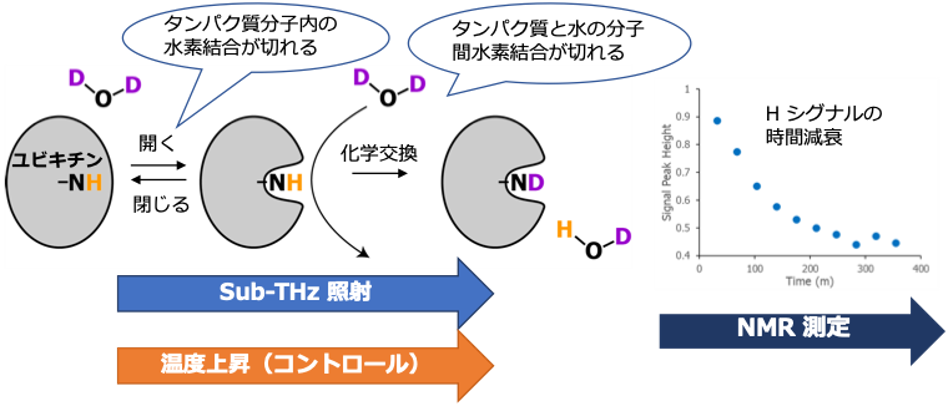
共同研究グループは、クライストロン型sub-THzパルス光源を用い、0.1 THz電磁波を照射したときのユビキチンの遅いダイナミクスの変化を、水素-重水素交換NMR分光法を用いて調べた(図2)。その結果、0.1 THz波照射によって、タンパク質の内部や疎水性表面に位置するアミドの水素-重水素交換が加速される一方で、表面の柔軟な構造領域に位置するアミドの交換は減速されることが明らかとなった(図1)。0.1 THz波照射は、同時にユビキチン試料温度を0.3 ℃上昇させた。そこで、0.1 THz波照射の効果を温度上昇と切り分けるため、非照射で温度を5 ℃上昇させた試料も解析した。その結果、0.1 THz波の照射作用は、温度上昇による熱の作用と質的に反対になることが明らかとなった(図1)。この結果は、タンパク質と水の界面において結合している両者の運動を、sub-THz波によって非熱的に励起できること、またその運動がタンパク質の機能に関わる遅いダイナミクスに影響を与えていることを示唆している。この成果は、sub-THz波の照射により、水との相互作用を介して、タンパク質の機能を制御できる可能性を示している。
■ 今後の予定 ■
生物の化学反応の溶媒は水である。生体高分子と相互作用する水の性質を理解し、上手く制御することができれば、次世代の生物機能改変技術になり得る。例えば、sub-THz波の照射により、酵素改変を行わずにPCR酵素の機能を高める技術や、ゲノム情報を変えずに生物の物質生産能を高める技術につながる可能性がある。本研究成果は、適切な条件でsub-THz帯の電磁波を照射することで、水とタンパク質の相互作用を非熱的に変化させることを明らかにした。今後、水との相互作用に基づくタンパク質の機能を制御する新技術として、sub-THz帯域の電磁波が有効であるかを徹底的に検証したい。
図2: Sub-THz照射システムと水素-重水素交換NMRを組み合わせた手法。解析対象としてユビキチンタンパク質を用いた。溶媒がD2Oの場合、熱運動でユビキチン構造が開いた時に主鎖のアミドプロトンが重水素に置換され、H NMR信号が消失する。この過程を測定する。タンパク質の開裂と化学交換のいずれの過程でも水素結合の切断が起こるため、この方法はsub-THz励起によって引き起こされる水素結合ネットワークの変化を高感度で捉えられる。コントロール実験として、Sub-THz波を照射せずに熱伝導によって温度を上昇させた。
投稿論文
- 論文タイトル:Nonthermal excitation effects mediated by subterahertz radiation on hydrogen exchange in ubiquitin
- 著 者:Y. Tokunaga, M. Tanaka, H. Iida, M. Kinoshita, Y. Tojima, K. Takeuchi and M. Imashimizu* (* corresponding author)
- 雑誌:Biophysical Journal, April, 21 (2021)
- DOI:10.1016/j.bpj.2021.04.013
用語の説明
◆
◆
◆
◆
◆
◆